Coraux : les ingénieurs des océans sont menacés
PDF
Les récifs coralliens sont l’un des écosystèmes les plus complexes et les plus riches de notre planète. Ils sont basés sur une structure minérale bioconstruite (ou biominérale) par les coraux qui procure des niches écologiques à de nombreuses espèces qui y trouvent nourriture et protection. Le succès des récifs coralliens repose sur la symbiose établie par le corail (hôte) avec des algues unicellulaires du genre Symbiodinium (zooxanthelles) qui permet la vie dans des eaux tropicales très pauvres en nutriments. Cette symbiose mutualiste a nécessité le développement de mécanismes d’adaptation entre les deux partenaires, contraints de s’ajuster à leurs besoins mutuels. Malgré ces adaptations, l’équilibre de la symbiose est fragile et dépend fortement des conditions environnementales. Lorsque le corail est soumis à de fortes pressions telles que des températures élevées, l’équilibre peut être rompu et les zooxanthelles expulsées par l’hôte, provoquant le blanchissement du corail et pouvant, à terme, mener à sa mort. À l’heure actuelle, de nombreuses menaces pèsent sur l’état de santé des récifs coralliens et l’équilibre symbiotique des coraux. À l’échelle globale, les récifs sont soumis à des modifications physique et chimique de leur environnement induites par le réchauffement climatique et l’acidification des océans. À ces changements s’ajoutent des pressions locales liées aux activités humaines telles que la pollution, la surpêche et le tourisme déraisonné. Malgré les capacités d’adaptation des coraux, les observations et modèles prédisent que plus de 90% des récifs mondiaux seront affectés par des épisodes de blanchissement majeurs d’ici 2050. Ces chiffres démontrent l’urgence et la nécessité d’agir pour préserver cet écosystème unique et indispensable à l’économie de nombreux pays.
1. Les récifs coralliens : hot-spots de la biodiversité
1.1. Les récifs coralliens : formation, répartition et importance
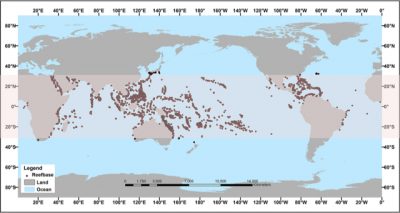
La France abrite près de 10% des récifs coralliens mondiaux avec notamment la barrière corallienne de Nouvelle Calédonie qui mesure 1600 km de longueur. Les récifs coralliens sont principalement répartis entre 30°N et 30°S, dans les zones tropicales et subtropicales autour de la ceinture équatoriale (Figure 1). La majorité d’entre eux se développe entre 0 et 30 m de profondeur, mais ils peuvent atteindre plus de 100 m de profondeur dans certaines régions du globe comme la Mer Rouge, où la lumière pénètre plus profond.
Les récifs coralliens représentent environ 0,16% des fonds marins (environ 600 000 km2) et 10,8% des fonds côtiers. Malgré leurs faibles superficies, les écosystèmes récifaux sont des réserves écologiques majeures qui abritent environ 30% de la biodiversité marine connue à ce jour [1] dont ¼ des espèces de poissons recensées [2]. Ils sont définis comme l’écosystème marin le plus riche en terme de biodiversité et sont souvent comparés à leur équivalent terrestre : la forêt tropicale.
Au-delà de leur importance écologique, les récifs coralliens rendent d’importants services écosystémiques à l’Homme. Bordant les côtes de plus d’une centaine de pays, ils jouent un rôle essentiel pour leurs populations. Leur extrême biodiversité contribue au développement économique de ces pays, grâce aux activités de pêche, au tourisme et à leurs apports en matériaux de construction. Ils assurent également un rôle de protection des côtes contre l’érosion, les tempêtes et les cyclones [3]. Au total, plus de 500 millions de vies humaines sont directement liées aux services rendus par les récifs coralliens. Les bénéfices nets apportés par les récifs coralliens (en prenant en compte la pêche, la protection des côtes et la biodiversité) varient selon les estimations de 30 milliards de dollars par an [3] à 375 milliards de dollars par an [4].
1.2. Fonctionnement du récif, le rôle clef du corail

Au-delà de son rôle de charpente, le corail est aussi une source de nutrition dans le récif. En effet, de nombreuses espèces de poissons broutent le corail et sont donc qualifiés de corallivores (Figure 2B,C). C’est le cas par exemple de certains poissons demoiselles, de gobies, de poissons papillons ou encore de poissons perroquets.
Par ailleurs, le corail est également une source majeure de matière organique dans le récif via l’excrétion de mucus. Ce mucus, composé principalement de glucides et protéines, est ensuite dispersé dans la colonne d’eau et utilisable par les autres organismes du récif (Figure 2D). La matière organique excrétée par le corail est essentielle au fonctionnement du récif car elle soutient la production benthopélagique (production au niveau des zones benthique, au fond de la mer, ou pélagique, dans l’océan ouvert) et participe au recyclage des éléments essentiels (azote, phosphore…) dans l’eau très oligotrophe [5] du récif [6].
2. Les coraux bâtisseurs de récifs
2.1. Les coraux Scléractiniaires, des animaux symbiotiques
Les coraux bâtisseurs de récifs, ou coraux de l’ordre des Scléractiniaires appartiennent à l’embranchement des Cnidaires, qui regroupent également les méduses, les anémones de mer ou les gorgones. Apparus au Précambrien, les plus anciens fossiles identifiés sont datés à -700 millions d’années. Les récifs « modernes » sont apparus quant à eux au Trias, il y environ 200 millions d’années, suite vraisemblablement au développement d’une association mutualiste (symbiose) entre le corail et un type d’algue unicellulaire communément appelée zooxanthelle.

Lors de leur description initiale, on pensait que les algues associées au corail, les zooxanthelles, appartenaient toutes à une seule espèce, Symbiodinium microadriaticum. Le développement des techniques d’analyse moléculaire a permis de démontrer qu’elles constituent un genre, Symbiodinium, recelant une large complexité d’espèces ou de sous-espèces non encore résolue à ce jour en terme de taxonomie [7].
La symbiose entre le corail (hôte) et les zooxanthelles est mutualiste car les deux partenaires tirent des bénéfices de l’association (développés ci-après). Les zooxanthelles sont en fait intégrées à l’intérieur des cellules de l’hôte (voir figure 3E), c’est ce qu’on appelle une endosymbiose intracellulaire. Chaque corail contient en moyenne 1 million de zooxanthelles par cm2 de surface de tissu. Cette densité est remarquable et est en grande partie responsable de la couleur du corail.
2.1.1. Bénéfices de la symbiose
Le rôle des zooxanthelles pour le corail est principalement d’ordre trophique. En effet, en apportant une variété de composés carbonés (sous forme de glucides, acides aminés et lipides) à l’hôte, la photosynthèse des zooxanthelles constitue une source majoritaire de carbone pour le corail. La plupart des produits de la photosynthèse (75-95%) sont ainsi transférés à l’hôte qui les utilise majoritairement pour sa propre respiration et son métabolisme, ainsi que pour la production de mucus. Les zooxanthelles peuvent ainsi contribuer jusqu’à 100% aux besoins énergétiques de l’hôte. Le corail passe ainsi d’un statut d’organisme hétérotrophe (utilisation de sources de carbone organique via une nutrition hétérotrophe) à un statut d’organisme mixotrophe (utilisation à la fois du carbone organique via l’hétérotrophie et du carbone inorganique via la photosynthèse des zooxanthelles [8]).
Inhérents aux propriétés photosynthétiques des zooxanthelles, l’oxygène produit par la photosynthèse est une source importante pour la respiration de l’hôte (et bien sûr de ses zooxanthelles). Enfin, les zooxanthelles participent aux défenses contre les radiations lumineuses nocives (tel que le rayonnement ultraviolet) en produisant des molécules clefs de défense telles que les Mycosporine-like amino acids (ou MAAs), véritables filtres solaires.
Pour les zooxanthelles, la vie en association présente également de nombreux avantages. Par leur localisation intracellulaire, les zooxanthelles bénéficient d’un environnement protégé du broutage et de la stabilité du cytoplasme animal. Les zooxanthelles bénéficient en outre de l’azote et du phosphore provenant du recyclage des déchets métaboliques de l’hôte et du carbone inorganique (CO2) produit directement par le métabolisme animal [9] évitant ainsi toute perte inutile dans un milieu globalement pauvre en nutriments. Néanmoins, pour assurer une activité photosynthétique optimale, le corail participe activement à la fourniture de CO2, azote et phosphore en absorbant ces composés du milieu extérieur.
Ainsi, la symbiose corallienne est une association qui bénéficie à la fois à l’hôte, qui acquiert une nouvelle capacité métabolique, et aux zooxanthelles qui bénéficient d’un environnement stable et d’un accès constant aux éléments nécessaires à leur métabolisme.
2.1.2. Coûts de la symbiose
Malgré ses avantages importants, la symbiose impose également un coût aux deux partenaires et conduit à des processus de co-évolution pour les limiter. Par exemple, en raison de ses besoins en lumière pour réaliser la photosynthèse, l’hôte est contraint de se développer uniquement dans la zone euphotique où l’exposition à de fortes intensités lumineuses peut provoquer un important stress oxydant. Par ailleurs, la majeure partie des photosynthétats produits par les zooxanthelles est transférée vers l’hôte animal ce qui constitue une perte très supérieure aux 5% perdus dans le milieu par les algues libres. Enfin, les apports en oxygène des zooxanthelles, constituent certes un avantage métabolique, mais aussi une contrainte chimique conditionnée par les conséquences d’une forte hyperoxie tissulaire conduisant à une production accrue d’espèces réactives de l’oxygène. La symbiose a ainsi été accompagnée par une multiplication des défenses antioxydantes (tels que des enzymes comme les superoxydes dismutases) qui permettent de contrer ses agents nocifs.
2.1.3. Le corail, un holobionte
Si la symbiose phototrophe entre les zooxanthelles et le corail reste la plus connue, on sait aujourd’hui que le corail héberge également de très nombreux autres organismes : bactéries, archées, protistes, champignons, virus, dont l’ensemble forme une communauté fonctionnelle appelée holobionte. Les microorganismes constituant ce microbiote sont répartis en communautés qui se développent dans différents compartiments du corail présentant des conditions physicochimiques particulières. On retrouve des communautés distinctes entre les tissus, le mucus, le squelette et la cavité gastro-vasculaire [10]. Leur rôle, encore peu connu, semble varié et dépend là encore du compartiment dans lequel elles se situent. Par exemple, dans le mucus, les ciliés empêchent la fixation d’organismes parasites en créant un courant de surface de l’ordre de 2 mm.s-1. Les bactéries associées au mucus ont quant à elles un rôle de protection contre d’autres bactéries pathogènes ou des virus [4] et participent au recyclage des nutriments dans l’holobionte en dégradant la matière organique excrétée par le corail. Dans les tissus et le squelette, des cyanobactéries, ou autres bactéries diazotrophes, réalisent la fixation de diazote, constituant une source potentielle d’azote pour l’hôte et les Symbiodinium. Cette source d’azote ainsi que les sucres synthétisés par la photosynthèse des bactéries capables de fixer l’azote atmosphérique (dites diazotrophes) peuvent être de grande importance pour la survie de l’holobionte dans des conditions de blanchissement.
2.2. Du corail au récif, la biominéralisation
La structure physique des récifs coralliens est formée par les polypes des coraux qui réalisent la calcification, c’est-à-dire qu’ils synthétisent un squelette calcaire à partir des ions Ca2+ et HCO3– de l’eau de mer. Ce processus est appelé minéralisation biologiquement contrôlée ou biominéralisation [11]. Le squelette des coraux est constitué de la superposition organisée de couches de cristaux d’aragonite (une forme de cristallisation du carbonate de calcium CaCO3) insérés dans une matrice organique constituée principalement de protéines riches en acides aminés acides et en phospholipides. La matrice organique permet au corail d’exercer un contrôle biologique sur la calcification, imposant la morphologie du squelette de l’échelle nanométrique à l’échelle centimétrique.
Les coraux présentent une large plasticité phénotypique expliquée par la forte influence des paramètres environnementaux sur la morphologie du squelette. Parmi ces paramètres, la lumière joue un rôle clé. Yonge & Nicholls [12] avaient observé que la lumière était indispensable à la formation des récifs et que ce lien pouvait dépendre de la photosynthèse des zooxanthelles. Ce processus est connu aujourd’hui sous le nom anglophone de « Light-Enhanced Calcification » (LEC ou Calcification stimulée à la lumière) : à la lumière, le taux de calcification est ainsi multiplié par un facteur de 3 en moyenne mais ce facteur peut atteindre des valeurs extrêmes de 127 en fonction des conditions environnementales et des espèces [12],[13]. Cette stimulation se met en place dès l’apparition de la lumière : en condition de laboratoire par exemple, 25 minutes après l’allumage des lampes, le taux de calcification du corail passe de sa valeur nocturne à sa valeur diurne. Le(s) mécanisme(s) sous-tendant cette relation reste(nt) très débattu(s).
Les zooxanthelles pourraient favoriser la calcification en fournissant l’énergie et l’oxygène nécessaires à sa réalisation ainsi que des précurseurs utilisés pour la synthèse de la matrice organique. En absorbant le gaz carbonique nécessaire à la photosynthèse, elles pourraient également favoriser une augmentation du pH dans les tissus de l’animal, créant ainsi des conditions favorables à la calcification. Enfin, en absorbant certains composés toxiques comme les phosphates, elles pourraient réduire l’inhibition de la calcification. Il est à noter que ces différentes hypothèses ne sont pas exclusives et que plusieurs peuvent coexister [10].
3. Les coraux, des organismes dans un environnement changeant

3.1. Le réchauffement climatique et le blanchissement corallien
L’augmentation de la température des océans, liée au réchauffement climatique, favorise les épisodes de blanchissement dont l’ampleur et la fréquence augmentent [14]. En 2016 par exemple, des anomalies de température de surface allant jusqu’à +3°C dans certaines régions ont été enregistrées et ont provoqué de sévères épisodes de blanchissements coralliens partout dans le monde. En 2017 encore, un blanchissement massif a touché la grande barrière de corail.
La température est un paramètre environnemental primordial car elle contrôle le métabolisme et la croissance des coraux. En effet, la plupart des réactions chimiques de l’organisme sont catalysées par des enzymes dont l’activité dépend principalement de la température. L’activité enzymatique est minimale à faible température puis augmente jusqu’à un optimum de température au-dessus duquel elle est ensuite inhibée. Par conséquent, la photosynthèse, la respiration et la calcification augmentent de façon linéaire avec la température, jusqu’à un optimum qui dépend très souvent de l’espèce étudiée, avant de diminuer de nouveau.
La frontière entre les effets bénéfiques et nocifs de la température est étroite. En effet, en plus d’inhiber les enzymes du métabolisme, la température peut, au-delà d’une certaine valeur (variable selon les espèces de coraux), altérer l’activité photosynthétique et produire des radicaux libres en excès, augmentant le stress oxydant [15] dans les cellules.
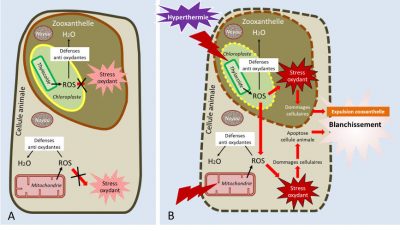
Pour limiter les dommages causés par un stress thermique, les coraux synthétisent des protéines chaperonnes, appelées protéines de choc thermique (HSP ou heat shock protein) qui protègent les cellules de l’effet d’un stress et permettent le maintien de la fonction des protéines auxquelles elles s’associent. Elles protègent par exemple la fonction des transporteurs d’électron de la photosynthèse et de la respiration, limitant ainsi le stress oxydant.
En dernier recours, lorsque le stress thermique est trop important et que les coraux ne sont plus capables de contenir le stress oxydant, ils expulsent de manière massive les zooxanthelles, ce qui conduit à un blanchissement corallien massif (« mass bleaching event » des anglo-saxons). Si le stress perdure, la quantité de symbiotes n’est plus suffisante pour que le corail maintienne ses fonctions primaires et la colonie meurt (résumé des effets de la température, cf. Figure 5). Une température trop élevée est donc responsable des phénomènes de blanchissement et de fortes mortalités sur les récifs [16].
3.2. L’acidification des océans
Si une large partie du gaz carbonique d’origine anthropique s’accumule dans l’atmosphère, produisant par effet de serre le réchauffement de notre planète, une partie de ce gaz se dissous dans les océans. Cette dissolution induit une modification chimique de l’environnement marin appelée l’acidification des océans, ou encore l’autre effet du CO2. En effet, en se dissolvant dans les océans, le gaz carbonique provoque une diminution du pH de l’eau de mer selon la réaction :
- CO2 + H2O ↔ HCO3– + H+ (réaction 1)
(où HCO3– est le bicarbonate et H+ l’ion hydrogène acide)
L’acidité des océans a ainsi augmenté de 30% depuis le début de l’ère industrielle, (baisse de pH de 8,2 à 8,1 qui pourrait atteindre 7,8 à la fin de ce siècle), alors que le pH n’a pratiquement pas varié durant les derniers 30 millions d’années. L’acidification des océans provoque une modification de la chimie des carbonates, un système chimique complexe jouant un rôle majeur dans l’équilibre du pH de l’eau de mer et tous les fluides biologiques ainsi que dans la formation des roches sédimentaires. En effet, l’ion carbonate (CO32-) constitue la brique essentielle pour la formation des coquilles et autres squelettes d’invertébrés, dont le squelette des coraux lorsqu’il réagit avec le calcium (réaction 2) pour former le carbonate de calcium (CaCO3 ou calcaire) :
- CO32– + Ca2+ ↔ CaCO3 (réaction 2)
Lors de l’augmentation de l’acidité de l’eau de mer, les protons (H+) produits en excès vont réagir avec l’ion carbonate selon la réaction 3 :
- H+ + CO32– ↔ HCO3– (réaction 3)
Ainsi, l’acidification des océans réduit la concentration des carbonates dans l’eau de mer tout en augmentant celle des bicarbonates. Cette réduction a longtemps été imaginée comme l’origine de la diminution des taux de calcification constatés en laboratoire ou sur le terrain dans des conditions acidifiées. On sait maintenant que le principal mécanisme responsable des effets biologiques de l’acidification des océans est la diminution du pH par lui-même. En effet, le pH est un paramètre clé dans la physiologie des organismes puisqu’il régule de très nombreux processus cellulaires, dont l’activité de nombreuses protéines.
Parmi les effets biologiques de l’acidification des océans, on peut citer la diminution de la calcification et la perturbation de processus physiologiques comme la reproduction, la nutrition, etc..
Les études montrent cependant une grande disparité dans les sensibilités des organismes à l’acidification des océans, en particulier chez les coraux. L’étude de récifs coralliens soumis à des sources naturelles de gaz carbonique, par exemple en Papouasie Nouvelle Guinée, montre que les coraux massifs résistent bien, au moins jusqu’à un pH de 7,7, alors que les coraux branchus sont très sensibles [17]. S’il apparaît ainsi qu’il y aura dans un monde plus acide des gagnants et des perdants, la morphologie du récif sera fortement perturbée par la diminution de la biodiversité corallienne et une augmentation de la couverture algale [17].
De plus, des études en laboratoire montrent que même si certaines espèces de coraux peuvent paraître résistantes à l’acidification, leur croissance en longueur n’étant pas réduite, le squelette de ces colonies est plus poreux, rendant les branches plus fragiles et laissant entrevoir un avenir sombre pour les récifs coralliens.
3.3. Les enjeux de la situation actuelle : entre inquiétude et espoir
Les récentes observations et les modèles qui prennent en compte le réchauffement climatique prédisent la perte – ou une forte altération – de 90% des récifs d’ici le milieu du XXIe siècle si le réchauffement mondial est limité à 1.5-2°C d’ici 2100 (objectif fixé lors de la COP21 [18]). De plus, l’acidification des océans et d’autres facteurs environnementaux tels que l’eutrophication des océans augmentent les effets négatifs du réchauffement climatique.
De récentes études ont toutefois démontré le potentiel d’acclimatation physiologique des coraux aux fortes anomalies de température. Certaines espèces sont par exemple capables de modifier leur population de zooxanthelles et de réguler l’expression de leurs gènes pour renforcer les mécanismes de défenses et optimiser leur résistance à de fortes températures. D’autres sont capables de compenser la baisse de la photosynthèse en augmentant leur nutrition hétérotrophe. Cependant, ce degré de résilience reste faible et limité, et les capacités d’adaptation/acclimatation des coraux restent très discutées.
Les prédictions alarmantes sur le devenir des récifs coralliens ont déclenché une prise de conscience sur la nécessité d’agir afin de les protéger. Les scientifiques, les organisations non gouvernementales (ONG) et les autorités locales doivent travailler main dans la main pour préserver ce patrimoine. La protection effective de la biodiversité des récifs coralliens repose entre autre, sur notre capacité à réduire notre impact sur l’environnement et sur l’amélioration des conditions de vie des populations locales afin qu’elles puissent gérer de manière durable les ressources des écosystèmes dont elles dépendent.
Références et notes
Image de couverture – Source : © Joël Courtial
[1] Porter et Tougas (2001, In Encyclopedia of Biodiversity) avancent le chiffre de 93000 espèces décrites dans les récifs sur un total de 274 000 espèces marines connues.
[2] Allsopp, M., Pambuccian, S.E., Johnston, P. & Santillo, D. State of the World’s Oceans. (Springer Science & Business Media, 2008).
[3] Cesar, H.S.J. Coral reefs: their functions, threats and economic value. (2002).
[4] Costanza, R. et al. The value of the world’s ecosystem services and natural capital. Nature 387, 253–260 (1997).
[5] Un milieu oligotrophe est un milieu pauvre en éléments nutritifs nécessaires à la croissance des organismes marins.
[6] Bythell, J. C. & Wild, C. Biology and ecology of coral mucus release. J. Exp. Mar. Bio. Ecol. 408, 88–93 (2011).
[7] Le genre Symbiodinium est aujourd’hui divisé en 9 larges ensembles phylogénétiques, ou clades, nommés A à I. Chacun de ces clades est lui-même composé de nombreux sous-clades, aujourd’hui estimés à plus de 250.
[8] Houlbrèque, F. & Ferrier-Pagès, C. Heterotrophy in tropical scleractinian corals. Biol. Rev. 84, 1–17 (2009).
[9] Smith, D.C. & Douglas, A.E. The biology of symbiosis. (Edward Arnold (Publishers) Ltd., 1987).
[10] Bourne, D.G., Morrow, K.M. & Webster, N.S. Insights into the coral microbiome: underpinning the health and resilience of reef ecosystems. Annu. Rev. Microbiol. 70, 317–340 (2016).
[11] Tambutté, S. et al. Coral biomineralization: from the gene to the environment. J. Exp. Mar. Bio. Ecol. 408, 58–78 (2011).
[12] Yonge, C.M., Nicholls, A.G. & Yonge, M.J. Studies on the physiology of corals. 1, (British Museum, 1931).
[13] Gattuso, J.-P., Allemand, D. & Frankignoulle, M. Photosynthesis and calcification at cellular, organismal and community levels in coral reefs: a review on interactions and control by carbonate chemistry. Am. Zool. 39, 160–183 (1999).
[14] Hoegh-Guldberg, O. Climate change, coral bleaching and the future of the world’s coral reefs. Mar. Freshw. Res. 50, 839–866 (1999).
[15] En dégradant les complexes protéiques qui sous-tendent notamment les chaînes de transfert d’électrons des mitochondries ou des chloroplastes, une hyperthermie favorise la synthèse d’espèces réactives de l’oxygène (appelées ROS, pour Reactive Oxygen Species), nocives pour les cellules. Un état oxydatif a ainsi été mis en évidence chez les coraux soumis à une hyperthermie.
[16] Collins, M. et al. in Climate Change 2013 – The Physical Science Basis (ed. Intergovernmental Panel on Climate Change) 1029–1136 (Cambridge University Press, 2013).
[17] Fabricius, K.E. et al. Losers and winners in coral reefs acclimatized to elevated carbon dioxide concentrations. Nat. Clim. Chang. 1, 165–169 (2011).
[18] Conférence de Paris de 2015 sur le climat.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : COURTIAL Lucile, ALLEMAND Denis, FURLA Paola (14 janvier 2025), Coraux : les ingénieurs des océans sont menacés, Encyclopédie de l’Environnement. Consulté le 3 avril 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/coraux-ingenieurs-oceans-menaces/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







