Nourrir les plantes en polluant moins ?
PDF
Peut-on fertiliser des cultures, tout en respectant l’environnement ? Cette question, au cœur des préoccupations environnementales de notre société, n’a pas de réponse simple. Les plantes ont un besoin impérieux d’éléments minéraux pour pousser, vivre et se reproduire. Elles puisent ces éléments dans le sol grâce à leur système racinaire. Pourtant, la disponibilité des éléments minéraux dans le sol est très variable : elle dépend d’interactions multiples entre les paramètres physico-chimiques du sol, les nombreux micro-organismes qui y vivent et la biologie des plantes elles-mêmes. La compréhension de ces phénomènes éclaire les pratiques agronomiques de fertilisation minérale des cultures. Jusqu’à une période récente la nutrition des cultures s’est faite élément par élément, à partir d’un pronostic de productivité donnant lieu à des fertilisations souvent excédentaires et parfois dangereuses pour les sols. Comment réussir une fertilisation plus efficace grâce à des ajustements plus précis des apports, et donc des pratiques de fertilisation plus intégrées et moins génératrices de pollutions ?
- 1. Les minéraux essentiels à la vie des plantes
- 2. Les bases historiques de la nutrition des plantes et leurs limites
- 3. Disponibilité des minéraux dans le sol
- 4. Comment les plantes absorbent-elles les minéraux ?
- 5. Vers une fertilisation intégrée et raisonnée des cultures : dialogue entre biologie et agronomie
- 6. Messages à retenir
1. Les minéraux essentiels à la vie des plantes
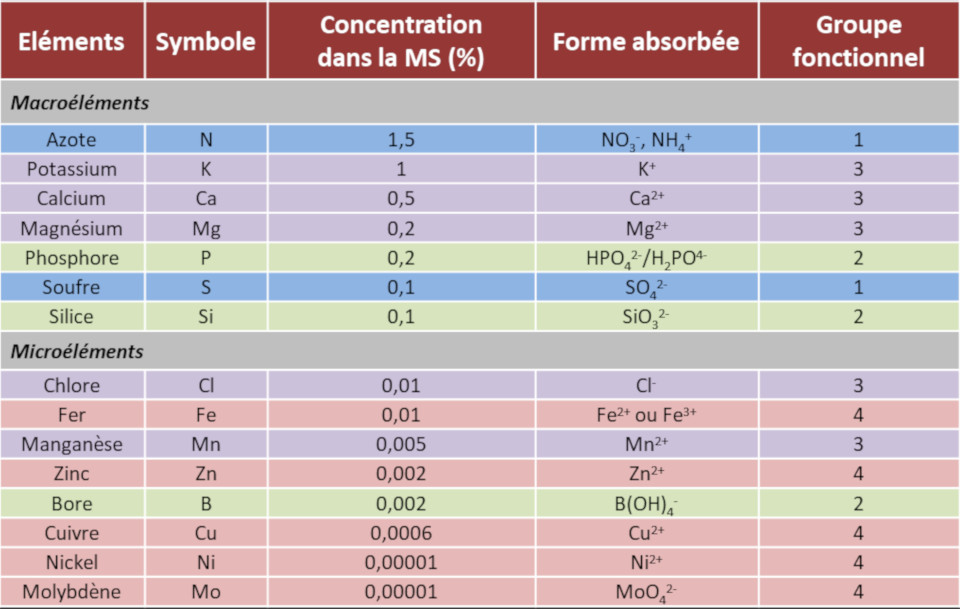
Au début du XIXe siècle, les progrès en chimie ont permis de déterminer la composition minérale de nombreux végétaux. En 1860, les physiologistes allemands Pfeffer, Sachs et Knop (Lire Focus Pionniers de la nutrition minérale) ont montré que les plantes peuvent croître sur un substrat inerte à condition d’ajouter dans l’eau une quinzaine d’éléments minéraux essentiels qui sont absorbés par les plantes sous forme d’ions avec une charge positive (cations) ou négative (anions). Ces techniques de culture faisant baigner directement les racines dans la solution nutritive sans substrat solide sont à l’origine de la culture en hydroponie (technique de culture hors-sol utilisant des solutions nutritives renouvelées et un substrat inerte comme du sable ou des billes de verre).
Les ions minéraux essentiels pour les végétaux ont été classés selon leur abondance relative en deux catégories, les macroéléments et les microéléments (Tableau 1).
- Les macroéléments, encore appelés éléments majeurs, (N, P, K, S, Ca, Mg) représentent chacun au moins 0,1% de la matière sèche de la plante et ne dépassent généralement pas 2% de celle-ci.
- Les microéléments (Mn, Zn, Cu, Fe, Ni, Cl, B, Mo), aussi nommés oligoéléments ou éléments traces, représentent une partie insignifiante de la matière sèche des plantes (de 0,01% à 0,00001%), malgré leur rôle essentiel dans la physiologie des végétaux.
Tableau 1. Macroéléments et microéléments des plantes. Concentration dans la matière sèche végétale (en %) et forme absorbée.
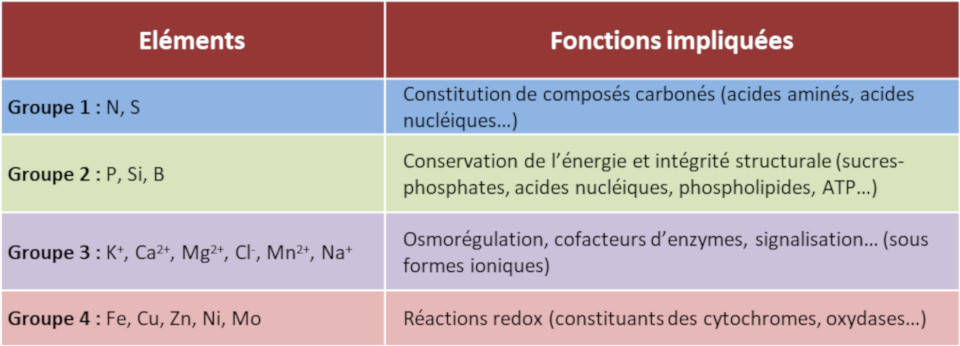
Les divers éléments sont impliqués dans une grande diversité de fonctions (Tableau 2) :
- Les ions minéraux -comme l’azote, le phosphore, le soufre- sont assimilés par les plantes dans les molécules organiques constitutives du vivant (acides nucléiques, acides aminés, lipides, etc.).
- L’oxygène dans ces molécules génère des groupes porteurs de charges négatives (groupe carboxyle et phosphate par exemple). L’azote génère des charges positives (amines). La quantité d’atomes d’oxygène est bien plus importante que celle d’atomes d’azote dans les biomolécules. De ce fait, la plupart de ces molécules sont porteuses d’une charge électrique négative nette. Cette charge négative des molécules organiques est compensée électriquement par la présence de grandes quantités de cations inorganiques, K+, Ca2+ et Mg2+.
- Le potassium est le cation inorganique le plus abondant du cytoplasme des cellules végétales. Il contrôle leur pression de turgescence (pression du contenu de la cellule contre la paroi) et le potentiel hydrique (potentiel de l’eau à quitter un compartiment donné) de la plante. Il est donc impliqué dans le contrôle de l’élongation et de la croissance cellulaire et dans la régulation de l’ouverture stomatique.
- Les minéraux participent aussi à la conservation de l’énergie dans les cellules et à de nombreuses réactions enzymatiques en tant que co-facteurs. Par exemple, le magnésium se trouve au cœur de la chlorophylle (Lire Les couleurs des feuilles) ; les centres fer-soufre et l’hème ferrique de certaines protéines participent aux processus d’oxydo-réduction cellulaire et au transfert d‘électrons des chaines photosynthétiques et respiratoires [1].
Tableau 2. Fonctions des éléments minéraux dans la plante.
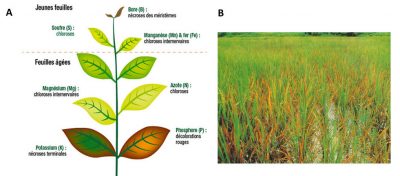
Dans les deux situations la physiologie de la plante sera altérée, provoquant des baisses de production de biomasse et éventuellement la mort dans des cas extrêmes. L’homéostasie des minéraux dans la plante est donc un processus vital essentiel. Ceci explique que l’absorption des minéraux par les racines implique des mécanismes actifs contrôlés génétiquement en réponse à la disponibilité de ces ions dans le sol (voir parties 3 et 4).
2. Les bases historiques de la nutrition des plantes et leurs limites
La fertilisation minérale des cultures est une pratique qui consiste à apporter certains éléments minéraux dans les sols pour :
- Corriger des insuffisances du sol en certains éléments qui limitent la croissance des plantes et le rendement des cultures ;
- Restituer au sol régulièrement les quantités d’éléments exportés par les récoltes afin de maintenir la fertilité des sols sur le long terme.
La fertilisation peut être effectuée sous forme organique, par des apports de fumiers ou de composts contenant divers minéraux qui se libèrent dans le sol grâce à la minéralisation (voir plus loin Figure 6). Elle peut aussi avoir lieu avec des engrais minéraux de différentes formes ioniques. Pour les plantes, il n’y a pas de différence fondamentale entre les deux types de fertilisation. Ils aboutissent in fine tous les deux aux mêmes formes ioniques absorbées par les plantes (voir partie 1).
Les recherches en agronomie concernant la nutrition minérale des cultures sont basées sur la «loi du minimum» de Liebig (1855) : « Les plantes ne croissent qu’en fonction du niveau permis par l’élément nutritif qui est le plus limitant ». Son interprétation comme « loi des facteurs limitants» a engendré l’idée que la croissance des plantes était contrainte par des facteurs limitants successifs, indépendants entre eux, se manifestant de manière séquentielle au fur et à mesure que l’on agit sur le milieu par des mesures correctives. Trois domaines de réponse aux apports d’engrais peuvent être définis (Figure 3) [2] :
- Zone 1 : une réponse linéaire qui est indépendante du niveau des autres facteurs ;
- Zone 2 : une réponse décroissante qui est fonction du niveau des autres facteurs ;
- Zone 3 : une absence de réponse due à la limitation d’un autre facteur.
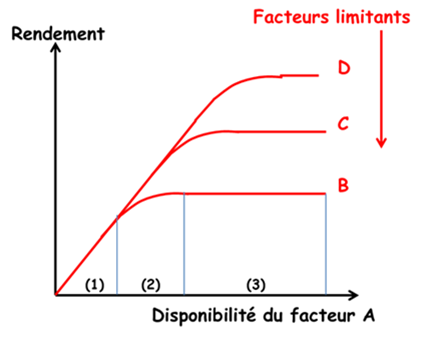
Cependant Liebscher, dès 1885, avait proposé une formulation plus complète sous la forme de la loi de l’optimum : « Chaque élément nutritif est utilisé de manière d’autant plus efficiente que la disponibilité de l’élément qui est le plus limitant est portée près de son optimum » (Figure 4). Ceci ouvrait la voie à une analyse des interactions entre les éléments, au-delà du simple effet « tout ou rien » de la loi de Liebig. Mais ces travaux sont restés largement ignorés. Ceci a eu pour effet une division excessive des recherches en compartimentant la réponse des plantes à chacun des principaux éléments majeurs N, P, K… et oligo-éléments.
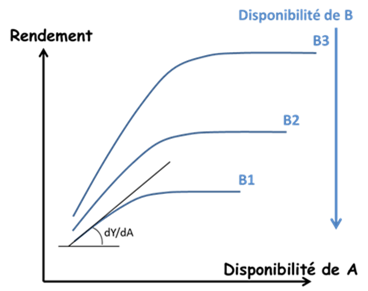
- L’analyse des interactions physico-chimiques entre les différents éléments nutritifs et la matrice minérale du sol a permis de quantifier la «disponibilité» in situ de ces éléments pour les plantes.
- Ainsi un « diagnostic du sol » (analyses de sol) fournit un «pronostic de nutrition» de la culture pour en déduire les corrections éventuelles à apporter par la fertilisation.
- En dehors de ces corrections, le concept de restitution basé sur une approche de bilan entre les exportations et les apports a constitué le fondement du raisonnement de la fertilisation minérale des cultures.
La « disponibilité » des éléments nutritifs les moins mobiles du sol (P, K, Ca, Mg…), et de la plupart des oligo-éléments, a été estimée par la détermination de valeurs « seuils » d’analyses de sol. Elles sont sensées traduire la capacité qu’auraient les plantes à prélever chacun des éléments, indépendamment les uns des autres, en fonction de leurs interactions plus ou moins fortes avec la matrice minérale du sol. Cependant, cette approche prédictive reste soumise à une très grande incertitude. Cela aboutit souvent à apporter « plus que nécessaire » pour être « certain d’avoir assez » du fait de l’aversion des agriculteurs aux risques de ne pas atteindre les rendements potentiellement possibles, conduisant à un excès généralisé de fertilisation.
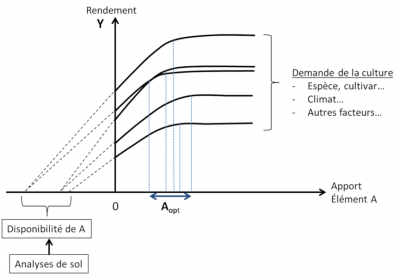
Les limites de l’approche « courbes de réponse » sont de deux ordres :
- La « disponibilité » des éléments est considérée séparément pour chacun d’eux, ignorant du même coup les interactions et co-limitations entre éléments ;
- La « disponibilité » des éléments n’est considérée que comme une variable externe à la plante. Elle est vue comme résultant uniquement des propriétés physico-chimiques locales du sol, excluant l’influence des autres composantes du système, la plante elle-même et le compartiment biologique du sol.
Cette vision linéaire « apport de fertilisant – disponibilité du sol – réponse de la culture » s’est révélée trop réductrice. La réalité du système « sol-plante-micro-organismes » est en fait plus complexe. En son sein de nombreuses rétroactions déterminent elles aussi la disponibilité réelle des éléments nutritifs pour les plantes. Cette disponibilité ne peut donc être totalement prédite a priori. Elle doit au contraire être considérée comme la résultante de la dynamique interne du système et comme l’expression de ses propriétés émergentes.
Dans le même temps et parallèlement, les recherches en écologie fonctionnelle, guidées par la seule compréhension du fonctionnement des couverts végétaux in natura, ont développé le concept de co-limitation entre facteurs du milieu [3],[4]. Ce concept implique des liens importants entre les différents facteurs limitants N, P, K, oligoéléments ainsi qu’avec l’eau. Il se rapproche donc davantage de la vision de Liebscher que de celle de Liebig. Il permet d’expliciter formellement les nombreuses interactions et rétroactions qui entrent en jeu dans le fonctionnement du système plante-sol.
En conclusion :
- L’approche linéaire et normative de la fertilisation minérale des cultures est apparue suffisante tant que son seul objectif était le rendement des cultures.
- Mais, dès lors que la qualité de l’environnement est devenue un objectif de même importance que le rendement, l’incertitude des « pronostics » engendrant une sur-fertilisation n’est plus acceptable.
- Une approche plus précise basée sur une meilleure connaissance des processus écosystémiques permettant d’éviter les excès devient donc indispensable.
3. Disponibilité des minéraux dans le sol
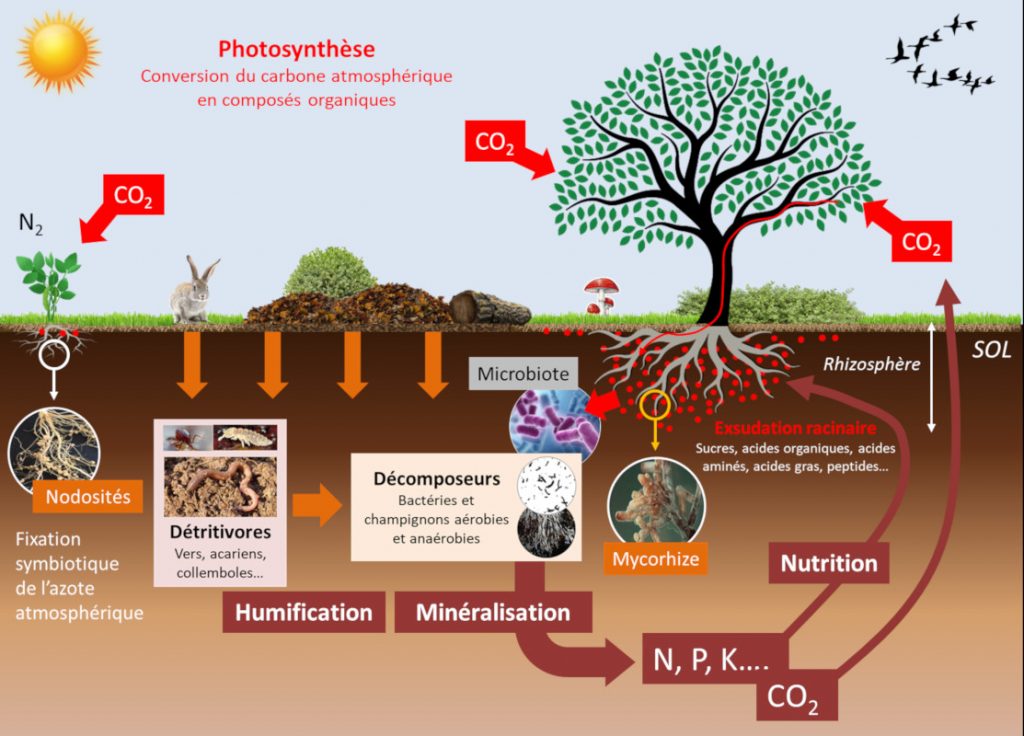
Pour être absorbés par les racines des plantes, les éléments minéraux doivent être présents dans la solution du sol (eau chargée d’ions qui circule dans les espaces libres ou pores du sol). Des interactions physico-chimiques existent entre les différentes formes ioniques des minéraux, ainsi qu’avec la matrice minérale et les colloïdes du sol (argiles, et matières organiques) :
- Elles déterminent l’équilibre dynamique entre les pools d’éléments de la solution du sol immédiatement disponibles pour les plantes et des pools moins disponibles plus ou moins adsorbés sur la matrice et les colloïdes.
- Le déplacement de l’équilibre entre les pools de disponibilité croissante sera plus ou moins rapide en fonction du pH et de la teneur en argile et en matières organiques des sols.
La disponibilité de chacun des éléments minéraux d’un sol pour les cultures peut être appréhendée à partir d’analyses de sol.permettent ainsi de prévoir la capacité du sol à réalimenter le pool minéral de la solution au fur et à mesure du prélèvement par la plante.
Les organismes vivants du sol influencent la disponibilité minérale du sol. Ces communautés d’organismes, telles que le microbiote et la micro– et macro-faune, établissent de multiples compétitions trophiques entre elles (Lire Les collemboles, acteurs de la vie du sol). En conséquence la composition de ces communautés est modifiée, entrainant la modification de la disponibilité des nutriments pour les plantes. Ces évènements se produisent dans une zone particulière du sol, la rhizosphère, qui est formée et influencée par les racines et les micro-organismes associés (voir Figure 6). Ces équilibres déterminent la disponibilité des éléments minéraux de la rhizosphère, qui, dans une boucle rétroactive, font évoluer les équilibres trophiques des sols.
En plus de leurs effets directs, les paramètres physico-chimiques influent sur les communautés d’organismes vivants du sol modulant fortement la disponibilité des minéraux pour la nutrition des plantes (voir Figure 6) :
- Par exemple, un pH basique du sol et les fertilisations avec des engrais azotés ou phosphorés influent négativement sur le niveau de mycorhization des racines par les champignons arbusculaires
- D’autre part, l’augmentation de la quantité de fer absorbée par des plantes très efficientes pour l’absorption de ce métal, dépend de la concentration de matière organique et de phosphate des sols sur lesquels ces plantes sont cultivées [5].
3.1. Importance des mycorhizes et du microbiote pour la nutrition des plantes
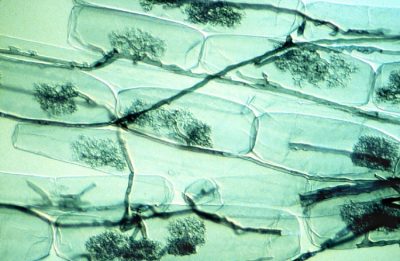
Les mycorhizes arbusculaires sont connues pour considérablement améliorer la nutrition en phosphore des plantes à partir des ions libres d’orthophosphate, H2PO4 et HPO4 (noté Pi) à partir de la solution du sol. Le phosphore est souvent limitant pour la croissance des plantes parce que Pi ne représente qu’une très faible fraction du phosphore total du sol, la plus grande partie étant sous forme organique. D’autre part, une zone de déplétion en Pi est rapidement créée autour de la zone d’absorption des racines. La capacité des espèces végétales à explorer de nouvelles zones contenant plus de Pi en solution constitue donc un avantage nutritionnel. Dans ce contexte les symbioses mycorhiziennes améliorent la nutrition en phosphore des plantes [7]. En effet le faible diamètre des hyphes mycéliens (en moyenne 10 mm) combiné à leur longueur qui peut représenter jusqu’à 1m par millimètre de racine, explique la meilleure nutrition en phosphore des plantes mycorhizées par rapport à celles qui ne le sont pas.
L’amélioration de la nutrition azotée des plantes par les mycorhizes a été montrée dans des systèmes expérimentaux simplifiés, mais cet effet ne semble pas aussi clair que dans le cas du phosphore. Les mycorhizes ne fournissent en tout cas pas l’azote aux plantes avec la même efficacité que les bactéries fixatrices d’azote de type Rhizobium lorsqu’elles établissent une symbiose avec les racines des légumineuses (luzerne, pois, haricots, etc.) (Lire Des plantes qui vivent de l’air du temps) (voir Figure 6).
Une partie importante du carbone fixé par les feuilles par la photosynthèse est secrétée par les racines dans la rhizosphère sous forme de molécules organiques [8]. Ces exsudats racinaires représentent entre 5 à 30 % des produits de la photosynthèse, soit entre 1 et 3 tonnes de C/ha/an (voir Figure 6). Ils nourrissent une importante communauté microbienne à l’interface sol-racine : le microbiote racinaire [9]. Celui-ci contient des agents pathogènes des plantes mais aussi des microorganismes symbiotiques qui aident les végétaux dans leur acquisition de l’eau et des minéraux. Les plantes ont la capacité de changer leur environnement racinaire et par conséquent de modifier leur microbiote (voir focus Websérie « La plante en kit », épisode 5 « La racine »). Cet aspect a été bien documenté dans le cas de la nutrition en fer des plantes. Il a en effet été montré que des plantes plus efficaces que d’autres dans l’acquisition du fer par les racines, appauvrissent leur rhizosphère pour ce métal. Il en résulte une modification de la composition du microbiote racinaire de ces plantes par une contre-sélection de bactéries spécifiques de la classe des Pseudomonas fluorescents, mieux adaptées à un environnement pauvre en fer, et bénéfiques pour la santé des plantes.
3.2. Les interactions entre organismes du sol au service de la nutrition des plantes
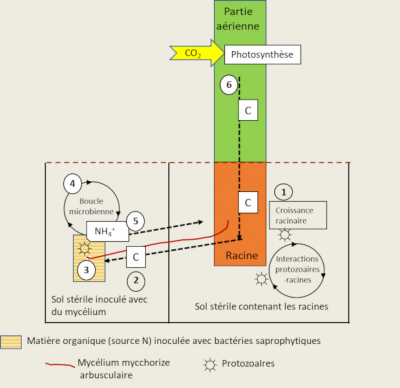
Des protozoaires et des nématodes se nourrissent des bactéries et du mycélium des mycorhizes, et rejettent ainsi de l’azote minéral dans le sol. Ce mécanisme connu sous le nom de boucle microbienne [10] aboutit à la modification de la composition des communautés microbiennes et des flux de nutriments minéraux du sol (Figure 8). Ces interactions entre les protozoaires, les mycorhizes arbusculaires et les racines, conduisent à une biomasse plus importante et à une accumulation d’azote dans les plantes selon le processus suivant :
- L’addition de protozoaires au sol contenant les racines stimule la photosynthèse, la fixation du carbone à partir du CO2, et le flux de carbone vers les racines ;
- L’augmentation du flux de carbone va aussi augmenter l’activité de prospection du sol des hyphes mycéliens ;
- Des bactéries saprophytiques sont capables de minéraliser l’azote à partir du patch de matière organique ;
- Les protozoaires se nourrissant des bactéries minéralisantes (la boucle microbienne) vont excréter de l’ammonium (NH4+) dans le milieu ;
- NH4+ va être alors absorbé par le champignon mycorhizien et transféré à la plante ;
- L’azote supplémentaire va stimuler la photosynthèse et la croissance de la plante, induisant une rétroaction positive conduisant à une augmentation de l’allocation de carbone aux racines et aux cellules du champignon.
Le phosphore organique du sol, essentiellement du phytate (acide myo-inositol hexaphosphorique : C6H18O24P6), n’est pas absorbé par le mycélium des champignons mycorhiziens. Par contre celui-ci peut recruter certaines bactéries qui sécrètent des enzymes capables de le minéraliser, les phytases. Ce Pi sera absorbé ensuite par le mycélium et in fine par les plantes.
4. Comment les plantes absorbent-elles les minéraux ?
4.1. Acquisition des minéraux par les racines et distribution dans la plante
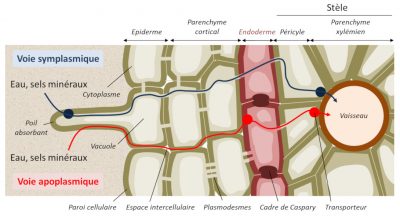
Les ions minéraux peuvent diffuser dans la paroi des cellules, appelée apoplasme, selon un gradient de concentration mais en arrivant au centre de la racine, ils rencontrent une barrière cellulaire appelée cadre de Caspary et la diffusion ne peut plus être passive (Figure 9). Le passage des ions nécessite donc à ce niveau une diffusion facilitée impliquant des protéines transmembranaires de transport d’ions, libres ou complexés à des molécules organiques (Figure 10).
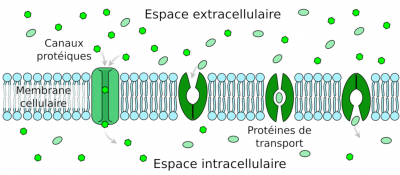
- les canaux ioniques, très spécifiques d’un ou de quelques ions, extrêmement rapides et avec une régulation de leur ouverture et de leur fermeture. Ouverts, les canaux ioniques sont traversés par les ions selon leurs gradients électrochimiques (différence entre le potentiel de membrane de la cellule et le potentiel d’équilibre de l’ion considéré). Le potassium utilise ce type transport ;
- les transporteurs, qui changent de structure pour déplacer les minéraux d’un côté à l ‘autre des membranes. Les transporteurs se différencient des canaux par le fait que ce n’est plus le gradient électrochimique des molécules qui assure le mouvement ionique mais le couplage du transport à une réaction enzymatique exergonique, comme l’hydrolyse de l’ATP. Le mouvement de la molécule devient donc unidirectionnel et peut même se produire contre le gradient électrochimique. Le transport utilisant ce type de protéines est saturable et plus lent qu’avec les canaux. L’azote, sous forme de nitrate ou d’ammonium, le phosphore sous forme de phosphate et le soufre sous forme de sulfate sont transportés dans les plantes par ce type de protéines. Certains métaux comme le fer ou le zinc peuvent être complexés à de petites molécules organiques pour être pris en charge par certains transporteurs. Les plantes peuvent également secréter des molécules organiques pour prendre en charge les métaux à l’extérieur des racines et les acheminer jusqu’à leurs transporteurs.
Les protéines de transport des minéraux sont régulées positivement ou négativement à plusieurs niveaux afin d’en absorber plus ou moins, selon leur disponibilité dans le sol et la demande de la plante.
- La régulation génétique de l’expression des gènes codant les protéines de transport s’adapte à la concentration en minéraux disponibles dans le sol.
- La topographie des protéines de transport, c’est-à-dire leur localisation précise dans la cellule, est essentielle à leur fonction.
- La signalisation longue distance est nécessaire pour réguler les protéines de transport des racines : la vitesse de croissance des parties aériennes de la plante définit sa demande en éléments minéraux. En fonction de cette demande des signaux (petites molécules organiques) sont émis par les feuilles et transportés vers les racines. Là, ils provoquent la régulation positive ou négative, en fonction des besoins de la plante, des transporteurs de minéraux.
4.2. Interactions entre minéraux et nutrition minérale des plantes
Différents ions minéraux de charges opposées interagissent dans le sol. Beaucoup d’entre eux sont alors moins mobiles et deviennent moins disponibles pour nourrir les plantes. Ceci entraîne des effets négatifs sur leur croissance et leur développement. Ces interactions existent également à l’intérieur des plantes. Toutefois, nous ignorons encore comment elles contrôlent la croissance des végétaux.
La perception de la disponibilité en nutriments du sol par les plantes leur permet de s’adapter à cette disponibilité. Elle a été étudiée de manière séparée pour différents éléments nutritifs. Or, l’interaction entre les homéostasies des différents nutriments est une règle générale et les rapports stœchiométriques entre éléments minéraux sont activement maintenus chez les plantes. Les réponses des plantes à des stress simples (carence en un seul élément minéral par exemple) ou à des stress combinés (carences simultanées en plusieurs éléments) impliquent des programmes génétiques différents. L’étude de l’effet de stress combinés sur la croissance des plantes révèle des «propriétés émergentes» qui ne peuvent pas être détectées en étudiant l’effet de chaque élément pris isolément.
Il existe ainsi de fortes relations entre les réponses des plantes à différents nutriments pris deux par deux. Par exemple :
- Lors d’une carence en zinc on observe une augmentation de la concentration en phosphate ;
- La carence simple en fer, connue pour diminuer l’accumulation de chlorophylle dans les feuilles, n’a pas cet effet lors d’une double carence en fer et en phosphate ;
- La croissance des racines en condition de carence en phosphate dépend aussi de la disponibilité d’autres nutriments tels que l’azote.
5. Vers une fertilisation intégrée et raisonnée des cultures : dialogue entre biologie et agronomie
5.1. Une notion essentielle pour améliorer la fertilisation : la dilution de l’azote
Des études [12] ont montré qu’il existe une relation dite d’allométrie [13] entre le prélèvement critique d’azote d’une culture (appelé Nc et exprimé en kgN/ha, c’est-à-dire la quantité minimum d’azote que la culture doit prélever pour réaliser sa croissance maximum) et l’accumulation maximum en matière sèche ou Wc (exprimée en t/ha) :
Nc = aWcb (1)
La valeur du coefficient « a » représente la quantité minimum d’azote que la culture doit absorber pour produire une biomasse de W = 1 t/ha. Le coefficient « b » qui est <1 indique que la quantité de N nécessaire pour produire les unités de biomasse suivantes diminue au fur et à mesure que la biomasse de la culture augmente.
Ceci se traduit par une expression de la diminution de la concentration en azote de la plante (%N) lors de la croissance de la culture, phénomène appelé « dilution de l’azote » :
% Nc = a/10 Wcb-1 (2)
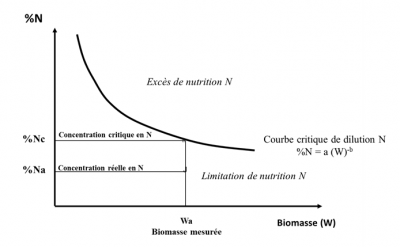
Ceci est réalisé par le moyen d’un indice de nutrition azotée INN = % Na / % Nc :
- une valeur de INN inférieure à 1 (% Na étant alors situé au-dessous de la courbe critique) indique et quantifie un déficit de nutrition azotée de la culture ;
- une valeur de INN supérieure à 1 (% Na étant alors situé au-dessus de la courbe critique) quantifie un excès ou une « consommation de luxe» d’azote (Figure 11). [14]
Cette relation d’allométrie de l’équation (1) traduit en réalité la co-régulation du prélèvement de l’azote par :
- la disponibilité de l’azote minéral dans le sol ;
- la dynamique de croissance de la plante elle-même selon les mécanismes de rétro-contrôle de l’absorption racinaire qui sont décrits dans le § 4.
5.2. Significations biologiques et agronomiques de la dilution de l’azote
Comment interpréter de manière fonctionnelle cette dilution de l’azote au cours de la croissance des plantes observée chez toutes les espèces ? Plusieurs phénomènes concourent à cette dilution :
- Les plantes sont essentiellement composées de deux types de tissus :
- les tissus photosynthétiques foliaires riches en azote [15] qui captent la lumière et assimilent le CO2 (concentration en N de 4 à 5%) ;
- Les tissus de soutien qui servent à l’architecture des plantes et qui sont pauvres en azote de (concentration en N de 0,5 à 0.7%).
- Lorsque la plante augmente de taille, la croissance en masse des tissus de soutien augmente plus rapidement que celle des tissus foliaires. Ceci est d’autant plus accentué que la plante se trouve dans un couvert végétal dense dans lequel elle doit croître davantage en « hauteur » et en « épaisseur » pour pouvoir positionner ses surfaces foliaires dans les strates éclairées.
- La masse des tissus « métaboliques » riches en azote (les surfaces foliaires) augmente donc relativement moins vite que la masse des tissus « de soutien » pauvres en azote au fur et à mesure que le couvert végétal se développe.
- De plus, l’azote contenu dans les feuilles à l’ombre est peu efficace pour la photosynthèse à faible luminosité. Il est recyclé dans la plante dans les jeunes feuilles bien éclairées au sommet du couvert végétal.
Il résulte de cet ensemble de phénomènes d’adaptation architecturale pour l’accès à la lumière que la demande élémentaire en azote de la plante, dN, pour élaborer une unité supplémentaire de biomasse, dW, diminue au fur et à mesure que la plante alloue une proportion de plus en plus importante de sa biomasse aux tissus de « soutien » pauvres en azote. Ceci entraîne donc une « dilution de l’azote » générée par la croissance du couvert végétal. C’est une propriété émergente de la population de plantes en compétition pour la lumière que constitue une culture.
Cette propriété émergente est donc déterminée par la biomasse de la culture. En conséquence, pour comparer l’état de nutrition minérale de deux cultures, il convient de prendre en compte leur différence de biomasse. Cela revient à les comparer à biomasse équivalente (W)b (voir Equation 1), celle-ci représentant le compartiment métabolique de la plante [16]. L’homéostasie de la nutrition azotée de la plante (c’est-à-dire la capacité d’une plante à maintenir son état nutritionnel constant) ne se réalise donc pas à l’échelle de la plante entière, mais de son seul compartiment métabolique.
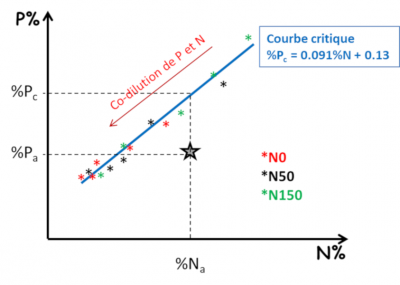
De manière similaire, des indices de nutrition K ou S (INK et INS) peuvent également être déterminés. La disponibilité de chaque élément pour la plante est donc subordonnée à la capacité de croissance de celle-ci. Or chaque élément peut être limitant pour la croissance de la plante. Il y a donc une forte interdépendance entre les différents éléments qui doit être prise en compte dans un diagnostic global de nutrition minérale. Par exemple, un apport de fertilisation azotée se traduisant par une augmentation de croissance de la plante augmente du même coup sa demande en P ou en K. La disponibilité en P et K peut ainsi s’avérer insuffisante, ce qui n’était pas le cas en absence d’apport d’azote.
En conclusion, cette nouvelle approche de diagnostic in situ de la nutrition minérale des cultures repose sur des courbes de concentration critiques qui permettent d’effacer les « effets de dilution » engendrés par les différences de biomasse des cultures.
- Elle s’affranchit des incertitudes liées aux pronostics basés uniquement sur la composante physico-chimique du sol ;
- Les diagnostics INN, INP, INK ou INS… intègrent de facto les variables locales. Ils permettent de révéler un état nutritionnel des plantes au sein d’une culture ;
- Selon cet état, révélé par la valeur <1 ou >1 de cet indice, une décision de correction par la fertilisation peut être prise ;
- Le développement de tels outils de diagnostic devrait permettre aux agriculteurs de n’effectuer des apports correctifs qu’en cas de déficit nutritionnel avéré de la culture. Ceci devrait limiter les excès de fertilisation « de précaution » préjudiciables pour l’environnement.
6. Messages à retenir
- Les plantes absorbent les éléments minéraux du sol par des protéines membranaires de leurs racines. Les minéraux sont ensuite distribués dans la plante par la sève véhiculée dans les vaisseaux conducteurs.
- L’absorption des minéraux du sol dépend de leur disponibilité. Celle-ci est déterminée par les paramètres physico-chimiques du sol et par les interactions entre le sol, les micro-organismes qu’il contient et les plantes.
- La croissance des plantes détermine leur demande en minéraux et contrôle en retour leur absorption. Cette régulation implique une signalisation longue distance des feuilles vers les racines.
- Le transport des éléments minéraux et la fertilisation des cultures ont longtemps été considérés élément par élément. La fertilisation des cultures était alors basée sur des analyses de sol (a) ne tenant pas compte des interactions entre éléments et (b) considérant la disponibilité des éléments comme une variable externe à la plante.
- Lors de sa croissance, la plante maintien son homéostasie seulement au niveau du compartiment « métabolique » (surface foliaire) qui détermine sa croissance. Mais elle est obligée d’investir dans son architecture (tissus de soutien pauvres en N, P, K…) pour avoir accès à la lumière. La dilution des éléments minéraux est donc déterminée par l’allométrie indispensable entre « tissus métaboliques » (surface) et « tissus de soutien » (hauteur, épaisseur). Plus la plante est « grande » plus il lui faut de tissus de soutien par rapport aux tissus métaboliques…
- L’évolution récente de la fertilisation s’appuie sur ce concept de courbes de dilution. Elles permettent de s’affranchir des effets de dilution engendrés par les différences de biomasse des cultures. Elles devraient favoriser l’apport d’engrais minéraux uniquement en cas de déficit nutritionnel avéré, et ainsi limiter les excès de la fertilisation préjudiciables à l’environnement.
Références et notes
Image de couverture. Source : https://www.pxfuel.com
[1] Morot-Gaudry, J.F., Moreau, F., Prat, R., Maurel, C. & Sentenac, H. (2017). Biologie Végétale : Nutrition et Métabolisme. 242 pages, Dunod, Sciences Sup, 978-2-10-075887-6. hal-01594667
[2] Lemaire, G. (2020). La fertilisation des cultures : des bases scientifiques renouvelées. Les mots de l’Agronomie.
[3] Bloom, A.J., Chapin, F.S. & Mooney, H.A. (1985). Resource limitations in plants – An economic analogy. The Annual Review of Ecology, Evolution, and Systematics, 16, 363-392.
[4] Kho, R.M. (2000). On crop production and the balance of available resources. Agriculture, Ecosystems and Environment, 80, 71-85
[5] Robin, A., Vansuyt, G., Hinsinger, P., et al. (2008). Iron dynamics in the rhizosphere: consequences for plant health and nutrition. Advances in Agronomy, 99, 183–225.
[6] Brundrett, M.C. (2008). Mycorrhizal Associations: The Web Resource.
[7] Duponnois, R., Sanon, A., Hafidi, M., Ndoye, I. & Bâ, A. M (2013) Généralités sur la symbiose mycorhizienne : introduction.
[8] Agriculture de conservation des sols.com. Exsudats racinaires : l’essence même des sols.
[9] Deveau, A. & Martin, F. 26 octobre 2016. Microbiote : les plantes aussi ! Pour la Science N° 469.
[10] Plassard, C., Robin, A., Le Cadre, E., Marsden, C., Trap, J. et al. (2015) Améliorer la biodisponibilité du phosphore: comment valoriser les compétences des plantes et les mécanismes biologiques du sol. Innovations Agronomiques, INRA, 43, pp.115-138.
[11] La Nutrition minérale. A retrouver sur notre article « Le chemin du carbone dans la photosynthèse« .
[12] Lemaire, G. & Salette, J. (1984). Relation entre dynamique de croissance et dynamique de prélèvement d’azote pour un peuplement de graminées fourragères. I- Etude de l’effet du milieu. Agronomie, 4, 423-430.
[13] En biologie du développement, l’allométrie est l’analyse des croissances relatives entre les organes, tissus ou processus d’un organisme vivant.
[14] Lemaire, G., Jeuffroy, M.H. & Gastal, F., 2008. Diagnosis tool for plant and crop N status in vegetative stage: theory and pratices for crop N management. Eur. J. Agron. 28, 614–624..
[15] Grâce à la présence de la RubisCO, protéine la plus abondante de la feuille (elle représente en masse près de la moitié des protéines de la feuille) et principale réserve d’azote organique des feuilles (lire Focus « La RubisCO« )
[16] Ce concept correspond pour les plantes à celui du « poids métabolique » utilisé en nutrition animale.
[17] Lemaire, G., Sinclair, T., Sadras, V.O. & Belanger, G. (2019). Allometric approach to crop nutrition and implications for crop diagnosis and phenotyping: A review. Agronomie for Sustainable Development.
[18] Salette, J. & Huche, L. (1991) Diagnostic de 1’état de nutrition minérale d’une prairie par l’analyse minérale du végétal: principes, mise en oeuvre, exemples. Fourrages, 125, 3–18.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : BRIAT Jean-François, LEMAIRE Gilles (23 juin 2020), Nourrir les plantes en polluant moins ?, Encyclopédie de l’Environnement. Consulté le 6 avril 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/nourrir-plantes-polluant-moins/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.