Rôle des forêts dans le bilan de carbone de la planète
PDF
À l’échelle de la planète, les forêts constituent le principal puits de carbone en milieu continental. Cependant, à une échelle plus locale, si certaines forêts constituent bien des puits de carbone, d’autres jouent le rôle de sources. Le flux net de carbone dépend en effet de différents facteurs naturels et anthropiques. En particulier, les activités humaines peuvent aussi bien favoriser le stockage de carbone (protection et expansion des surfaces de forêts, effet fertilisant du CO2 libéré par les activités humaines) qu’au contraire en provoquer la libération (déforestation, dégradations).
- 1. Les forêts dans le bilan global de carbone
- 2. Répartition des stocks de carbone de la forêt
- 3. Augmentation du stock : la forêt comme puits de carbone
- 4. Diminution du stock : la forêt comme source de carbone
- 5. Où se situent les grands puits et sources forestiers de carbone ?
- 6. Atténuation, adaptation et reboisement
- 7. Messages à retenir
1. Les forêts dans le bilan global de carbone

La forêt est, selon la définition de la FAO [1], une surface caractérisée par un taux de couverture des arbres supérieur à 10 % et une hauteur des arbres supérieure à 5 mètres.
Les forêts représentent un immense stock de carbone via (i) la biomasse, (ii) le carbone du sol (sous forme de matière organique et de minéraux carbonatés), (iii) le bois mort et (iv) la litière (la fine couche de matière organique morte située au-dessus du sol). Ce stock évolue en fonction de facteurs naturels (morts des arbres anciens ou malades, croissance des autres) et anthropiques (déforestation, plantations) (Figure 1). Lorsque le stock de carbone emmagasiné dans la forêt augmente, la forêt constitue un « puits de carbone », tandis que si son stock diminue car le carbone est relâché dans l’atmosphère, elle constitue une « source de carbone ». Selon les régions, la forêt peut constituer une source ou un puits de carbone. Par exemple la déforestation tropicale conduit à une émission importante de CO2 dans l’atmosphère, alors que la croissance des arbres contribue au contraire à capter le CO2 atmosphérique.
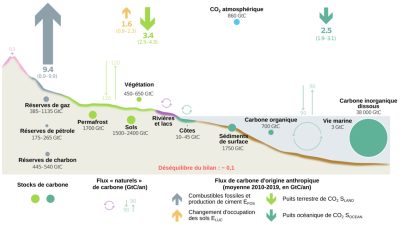
- Les émissions de CO2 liées à l’utilisation des combustibles fossiles et à la production de ciment (EFOS ≈ 9,4 ± 0,5 GtC/an). Si on estime la population de la planète à 8 milliards d’individus, cela représente une émission d’environ 1,2 tonnes de carbone par personne par an, avec cependant, dans la réalité, une très forte disparité selon les pays.
- Les émissions liées aux changements d’occupation des sols, principalement la déforestation (ELUC ≈ 1,6 ± 0,7 GtC/an). Ces émissions sont incertaines et estimées avec des modèles d’inventaire (book-keeping [4]) à partir des surfaces de forêt perdues ou gagnées.
- Les puits de CO2 terrestre (SLAND ≈ 3,4 ± 0,9 GtC/an) et océanique (SOCEAN ≈ 2,5 ± 0,6 GtC/an), estimés à partir d’un ensemble de modèles numériques 3D du cycle du carbone dans l’océan, et à partir d’un ensemble de modèles diagnostiques estimant les flux air-mer à partir de nombreuses mesures in situ de la pression partielle du CO2 à la surface des océans (SOCAT).
Au niveau de l’atmosphère, la différence entre les flux de carbone entrants (EFOS + ELUC = 9,4 + 1,6 = 11,1 GtC/an) et sortants (SOCEAN + SLAND = 2,5 + 3,4 = 5,9 GtC/an) conduit à une accumulation de 5,1 GtC/an. Ainsi, sur les 9,4 GtC/an libérées par les activités humaines, 5,1 GtC/an sont stockées dans l’atmosphère, soit 55 % des émissions.
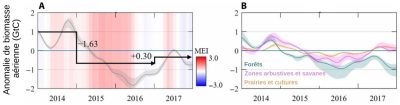
Les forêts capteraient, selon les estimations, entre 70 et 100 % des 1,8 GtC/an absorbés au niveau des surfaces continentales. Les surfaces non forestières (prairies, cultures, toundra, etc.) capteraient donc entre 0 et 30 % de ces 1,8 GtC/an. L’incertitude sur les contributions relatives des forêts et des zones non forestières dans le piégeage du CO2 traduit le fait que différentes méthodes, avec leurs incertitudes associées, sont employées pour estimer les stocks de carbone et leurs variations et qu’elles ne convergent pas vers les mêmes résultats. Quoi qu’il en soit, les forêts constituent le principal puits de carbone en milieu continental. En outre, elles représentent également une source de carbone via la déforestation. Comprendre le rôle des forêts dans le cycle du carbone est donc essentiel pour pouvoir faire face au réchauffement climatique.
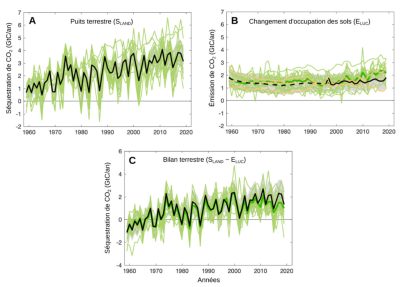
L’impact de la déforestation (ELUC) est assez stable, mais plutôt en augmentation ces dernières années (Figure 3). Le puits terrestre (SLAND) augmente, possiblement en lien avec les efforts de replantation et les effets fertilisant du CO2, mais il a tendance à stagner ces dernières années. Le puits de carbone terrestre résiduel total (SLAND – ELUC) est à peu près stable sur les deux dernières décennies (Figure 3).
Avant de nous intéresser aux changements de stocks de carbone, qu’ils soient positifs (forêt = puits) ou négatifs (forêt = source), considérons au préalable la répartition de ces stocks à l’échelle de la planète.
2. Répartition des stocks de carbone de la forêt
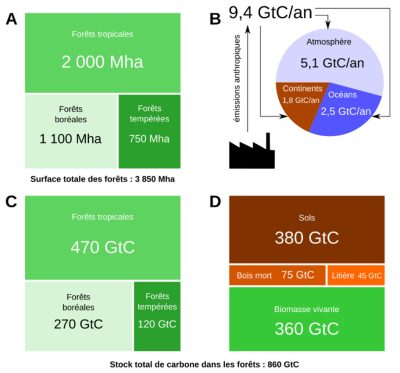
Les stocks de carbone de la forêt correspondent au stock de carbone présent dans la végétation (parties aériennes et souterraines), le sol, le bois mort et la litière. Les forêts couvrent la planète sur environ 3 900 millions d’hectares et se répartissent dans trois grands domaines géographiques : tropical pour 50 % environ (2 000 Mha), boréal (1 100 Mha) et tempéré (750 Mha) [5] (voir Table S2 de cette réf. [5]).
Selon une étude publiée en 2011 par Yude Pan et ses collaborateurs [5], les stocks des forêts de la planète sont de l’ordre de 860 GtC, dont 380 PgC (44 %) dans le sol (jusqu’à environ un mètre de profondeur), 360 GtC (42 %) dans la biomasse vivante (aérienne et souterraine), 75 GtC (9 %) dans le bois mort, et 45 GtC (5 %) dans la litière. Géographiquement, la forêt tropicale représente plus de la moitié des stocks (470 GtC, 55 %) et le reste du stock est reparti dans la forêt boréale (270 GtC, 32 %) et tempérée (120 GtC, 14 %) (Figure 4).
Comme précisé ci-avant, le stock de carbone des forêts change en fonction du climat, des activités humaines, etc. et ces changements peuvent être positifs (le carbone s’accumule dans la forêt, on parle alors de puits) ou négatifs (on parle alors de source). Considérons les principaux facteurs à l’origine de ces changements qu’ils soient positifs ou négatifs.
3. Augmentation du stock : la forêt comme puits de carbone
La photosynthèse convertit le carbone minéral de l’atmosphère en carbone organique qui s’accumule alors dans les arbres (feuilles, branches, troncs, racines) et dans le sol lorsque la forêt pousse. Si la forêt est en équilibre depuis de très nombreuses années (des siècles), les pertes de carbone liées à la mortalité des arbres les plus vieux ou dépérissant sont plus ou moins compensées par la pousse des jeunes arbres (voir section 3.1 spécifique au sujet des forêts anciennes et intactes) et les forêts anciennes peuvent donc être des puits ou des sources, mais de faible intensité par unité de surface.
Suivant Pugh et coll. [7], nous distinguons les forêts en deux grandes classes (i) les forêts de repousse et (ii) les forêts anciennes et intactes (définies par un âge supérieur à 140 ans). Ces auteurs estiment un puits de carbone de 1,30 GtC/an pour les forêts de repousse et de 0,85 GtC/an pour les forêts anciennes. Au total, ils estiment donc un puits global des forêts de l’ordre de 2,15 GtC/an, dont l’ordre de grandeur est comparable à celui du puits terrestre résiduel (1,8 GtC/an) estimé par le Global Carbon Project.
3.1. Forêts anciennes et intactes en pseudo-équilibre
Ces forêts correspondent à des forêts qui n’ont subi (en théorie) aucune intervention humaine depuis de nombreuses décennies : elles sont supposées relativement « intactes ». Il s’agit essentiellement des forêts tropicales, soit protégées, soit encore relativement inaccessibles aux activités humaines.
Dans une forêt très ancienne, en pseudo-équilibre avec son environnement, le stock de carbone reste relativement stable, ou alors, dans certaines conditions précises, augmente lentement avec une accumulation de carbone dans le sol. En effet, l’accumulation de carbone lors de la pousse des arbres est compensée par l’émission de carbone liée à la décomposition du bois mort et de la litière (via la respiration autotrophe dans la litière et le sol), qui résulte de la chute des feuilles, des branches et d’une mortalité naturelle des arbres les plus vieux (renouvellement de la biomasse). La décomposition des débris de bois mort n’étant pas instantanée, les émissions de carbone dans l’atmosphère liées à la mortalité des arbres ne sont pas immédiates : il y a un effet tampon lié à cette décomposition sur plusieurs années [3], [8].

Ainsi, un article très cité de Luyssaert et coll. [9] remet en cause l’idée que les forêts anciennes (old-growth) soient neutres sur un plan carbone. Ils estiment à partir de quelques sites que les forêts anciennes et intactes des régions tempérées et boréales constituent un puits de carbone important (environ 4,6 GtC/an). Cette valeur serait fortement surestimée selon Gundersen et coll. [10], qui proposent celle de 1,6 GtC/an pour les forêts anciennes (> 200 ans) de ces régions. Cette seconde estimation reste élevée, car elle est du même ordre de grandeur que le puits global terrestre (cf. section 1), et ne tient pas compte des pertes par les feux et les insectes. Par ailleurs, Pugh et coll. [8] estiment qu’il y a très peu de forêts anciennes dans les régions tempérées et boréales, ce qui confirme que les résultats de Luysseart et de ses collaborateurs seraient fortement biaisés par l’inclusion de forêts « gérées » dans leur étude [10].
Citons aussi deux études récentes de référence sur les tropiques qui incluent la plus grande partie des forêts « intactes ». Brienen et coll. [11], s’appuyant sur une base de données in situ très large sur des sites « intacts », constatent que la forêt d’Amazonie est bien un puits de carbone mais que ce puits est en déclin, en lien avec une diminution de la productivité et une augmentation de la mortalité. Ils concluent sur le fait que leurs résultats contredisent ceux de modèles (prenant généralement bien en compte l’effet fertilisant du CO2, mais pas celui de la mortalité) qui prédisent un puits de carbone continu et intense des forêts tropicales. L’étude de Hubau et coll. [12] confirme que nous aurions passé le pic de puits de carbone dans les forêts tropicales. Le puits dans la biomasse des forêts intactes d’Amazonie continue de s’affaiblir rapidement, tandis que celui d’Afrique (d’environ 0,66 MgC/ha/an ou tonne C/ha/an) entame seulement son déclin (la mortalité y étant plus faible qu’en Amazonie car les forêts tropicales africaines seraient davantage adaptées à des épisodes de sécheresses et de fortes températures).
Pour conclure, il semble que les forêts anciennes et intactes, que l’on trouve essentiellement dans les forêts tropicales, constituent un puits de carbone. Cependant, il convient de noter que cet effet « puits » est possiblement dû au rôle fertilisant du CO2 et que, s’il existe à grande échelle, il est probablement faible et en déclin du fait d’une mortalité croissante des arbres en lien avec à la sécheresse et l’augmentation des températures.
3.2. Forêts de repousse (regrowth forest)
3.2.1. Cas général

- des régions où la forêt est gérée (Europe occidentale, États-Unis, Canada) y compris des régions très vastes où une forêt généralement assez jeune se développe en lien avec des plantations massives (par exemple en Chine) ;
- l’abandon des cultures ou une gestion forestière moins intensive (Russie occidentale) ;
- des forêts secondaires « naturelles » qui repoussent après des feux, des dégradations ou la déforestation (dans les tropiques et les régions boréales principalement).
3.2.2. Cas particulier des forêts gérées
Parmi les forêts de repousse, nous présentons ici le cas particulier des forêts gérées. Une forêt bien gérée qui est coupée régulièrement par placettes aura un stock de biomasse relativement stable dans le temps, sauf si la gestion tend à augmenter la densité des peuplements. Mais une telle forêt peut également constituer un puits de carbone si les coupes servent à fabriquer des produits durables tels que des éléments de l’habitat (charpente, revêtement, mobilier). Ce stockage de carbone n’est pas éternel et, à terme, ces produits vont alimenter le stock de carbone atmosphérique. Cependant, ils peuvent présenter un effet retardateur sur des dizaines d’années. Cet effet tampon est augmenté si l’usage et la durée de vie de ces produits issus du bois s’accroît. La durabilité est particulièrement importante pour des essences qui résistent très bien aux attaques des parasites (mélèze, châtaignier, robinier faux-acacia, etc.) et nécessitent très peu de traitements chimiques, voire aucun. Ces essences devraient être donc être privilégiées chaque fois que les conditions s’y prêtent. Une forêt est bien gérée si les récoltes respectent la durabilité des forêts et évitent une surexploitation. Cela sous-entend aussi préserver la biodiversité qui rend la forêt plus résiliente à des événements perturbateurs (attaques parasitaires, tempêtes, incendies, etc.). Ainsi, si les cultures monospécifiques peuvent paraître plus rentables à court terme, elles sont davantage exposées à des risques majeurs (exemple des tempêtes – dont Klaus en 2009, Figure 8 – qui ont ravagé la forêt des Landes).

4. Diminution du stock : la forêt comme source de carbone
De très nombreux facteurs peuvent à l’origine d’une baisse des stocks de carbone de la forêt.
4.1. La déforestation
La déforestation correspond à la transformation d’une surface de forêt en une surface d’un autre type sur le long terme : zone de cultures, de pâturages, de friches arbustives, d’éléments urbains, etc. Cela ne comprend donc pas les coupes forestières conduites dans le cadre d’une gestion de la forêt sur le long terme et qui n’ont que des effets transitoires. Plus généralement, la déforestation est classée dans la catégorie des changements d’usages et d’occupations des sols (land-use and cover-change, LUCC). Comme nous l’avons vu, ce terme est l’un des principaux du bilan de carbone de la planète : la déforestation conduit à des émissions de CO2 dans l’atmosphère d’environ 1,6 ± 0,7 GtC/an. Ce terme, noté ELUC, correspond à la somme algébrique des flux de carbone sortant vers l’atmosphère (coupes d’arbres et respiration des sols après déforestation) et des flux de carbone entrant vers la biosphère (repousse des forêts après des changements d’usage des sols, par exemple sur des zones de cultures abandonnées).
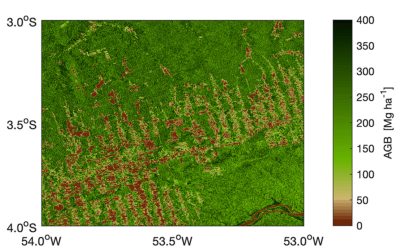
4.2. La dégradation des forêts

5. Où se situent les grands puits et sources forestiers de carbone ?
5.1. Méthodes d’étude
Tout d’abord, il convient de noter qu’il y a encore de grandes incertitudes dans l’estimation et la quantification des sources et puits forestiers de carbone à l’échelle de la planète.
En effet, si l’estimation du stock de carbone d’une forêt peut être faite relativement précisément à l’échelle locale sur quelques sites, c’est un travail très laborieux et difficile qui consiste à prendre des mesures détaillées des caractéristiques des arbres (hauteur, diamètre moyen du tronc à la hauteur standard de 1,3 m, densité, etc.) sur une placette représentative du peuplement forestier [18]. La spatialisation de ces estimations à une échelle nationale ou continentale reste encore très imprécise. La spatialisation peut s’appuyer :
- sur des données de télédétection [19],[20] via des observations optiques ou radar, mais ces mesures saturent pour de fortes valeurs de biomasse de la forêt. Il y a donc un débat dans la communauté sur la validité de ces estimations [21].
- sur des données lidar (qui mesurent la hauteur des arbres qui est bien reliée à leur biomasse) telles que celles fournies par le satellite GEDI [22], mais plusieurs années d’observations sont nécessaires pour couvrir l’ensemble de la planète. Ainsi, si des cartes globales de biomasse aérienne forestière sont disponibles [23],[24] elles ne permettent pas un suivi dynamique des changements de stocks.
Les estimations de ces variations s’appuient sur un travail d’inventaire [13] qui se fonde sur des données de suivi des changements des types d’occupations des surfaces (dont celui de la FAO) que l’on pondère par des estimations des stocks de carbone de ces différents types d’occupations. Mais les données d’inventaires présentent une qualité très variable d’un pays à l’autre et, d’autre part, les estimations de biomasse utilisées restent assez grossières.
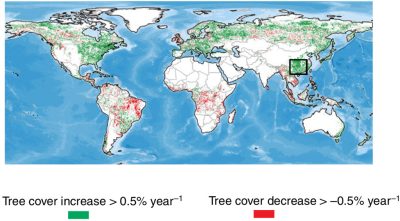
Très récemment des données d’observation micro-ondes passives (indice végétation L-VOD à grande longueur d’onde, environ 20 cm) ont permis de cartographier les grands puits et sources de carbone continentaux en termes de biomasse aérienne [25]. Les produits basés sur les observations optiques permettent aussi d’estimer l’évolution du taux de couvert des forêts [26] (voir Figure 12 et Focus Carbone & biomasse des forêts).
5.2. Principaux résultats
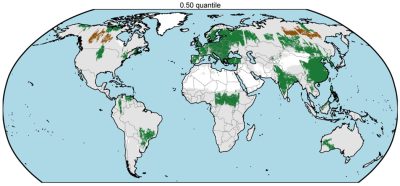
Nous donnons ici les grandes lignes de résultats très récents et parfois toujours en cours d’analyse. Comme indiqué précédemment, les forêts de repousse constituent d’importants puits de carbone. Ainsi, le programme de reforestation mené en Chine depuis plusieurs années, en particulier dans le sud du pays, est responsable d’un puits de carbone d’environ 0,15 GtC/an. La partie occidentale de la Russie piège également beaucoup de carbone, probablement grâce à l’abandon de certaines zones cultivées et à une diminution de l’exploitation des forêts. Il y a aussi des puits répartis dans l’ensemble des tropiques en lien avec (i) les forêts secondaires, c’est-à-dire qui poussent sur des zones anciennement exploitées, (ii) une diminution des dégradations liées à certains contextes politiques (par exemple, guerre civile en Centrafrique), (iii) des conditions plus humides et propices à la pousse des forêts (sud-est de l’Afrique et centre-est de l’Amérique du Sud).
Notons que ces régions correspondent généralement aux régions dites de verdissement (greening) mises en évidence par les satellites optiques (Figure 13) [27]. Cependant, le phénomène de verdissement ne traduit pas forcément un puits de carbone. Par exemple, suite à un incendie ou une coupe forestière, une végétation basse peut se reconstituer très vite et les satellites optiques mesurent alors un verdissement via des indices de végétation (NDVI, indice foliaire), alors que des images micro-ondes L-VOD, qui pénètrent dans la végétation et sondent toute la biomasse, indiquent bien une chute des stocks de carbone.
Plus récemment, une étude a montré que la partie brésilienne de l’Amazonie n’était plus un puits, mais une source de carbone sur la dernière décennie [30]. La nouvelle, très symbolique, a fait le tour du monde, reprise par de nombreux journaux (Figure 14). L’article montre aussi que l’impact des dégradations (« cachées », car généralement non détectées par des satellites optiques) dépasse celui de la déforestation.

6. Atténuation, adaptation et reboisement
Face aux changements climatiques en cours, il est vital d’agir en termes d’atténuation et d’adaptation. L’atténuation consiste à utiliser les capacités des forêts à absorber le CO2 pour en réduire la teneur atmosphérique. Cela peut par exemple passer par une utilisation plus importante du bois dans les éléments durables de l’habitat (mur, parquet, charpente, isolation, etc.).
L’adaptation des forêts a pour objectif de les rendre moins vulnérables au changement climatique afin d’éviter qu’elles ne deviennent des sources de carbone. Un des éléments clefs est l’adaptation aux températures élevées et à la sécheresse. En effet, les changements climatiques sont si rapides que les forêts n’ont pas le temps de s’adapter, en particulier via des changements de répartition des espèces où celles mieux adaptées à un climat chaud et sec viendraient se substituer à des espèces peu ou pas adaptées aux nouvelles conditions. Ces dernières subissent mortalité et dépérissements en lien avec des attaques d’insectes ou de champignons et des dégâts abiotiques (gel printanier et sécheresse estivale). En France, les espèces les plus touchées sont les hêtres, les châtaigniers, certaines espèces de chênes et de pins ainsi que les épicéas qui vont disparaître des régions où elles ne sont plus adaptées. Inversement, certaines espèces prospèrent, à l’image du chêne vert (Figure 15) en Aquitaine qui remplace progressivement par endroit le chêne pédonculé qui supporte moins bien le stress hydrique [31].
Une des solutions pour accélérer l’adaptation des forêts est de replanter avec des espèces et variétés mieux adaptées aux conditions climatiques actuelles et à venir (voir par exemple le projet RENEssences de l’Office national des forêts).

Ainsi, replanter massivement peut créer des tensions sur les ressources en eau, car les arbres en consomment beaucoup, ce qui épuise les réserves des sols et peut rendre les reboisements peu durables [32]. Il est donc préférable de replanter dans des régions où la disponibilité en eau est suffisante et où les forêts disparaissent du fait de perturbations anthropiques (déforestation, dégradations, incendies). On peut citer en particulier de vastes régions du bassin d’Amazonie et de la Russie.
Par ailleurs, les replantations ont un bilan carbone très négatif à cause de l’énergie dépensée pour la culture des plants, de l’utilisation d’engins mécaniques, de la construction de routes, etc. Par ailleurs, les arbres plantés peuvent subir des épisodes de mortalité massive (par manque d’irrigation) et les plantations se font souvent avec une seule espèce, ce qui est très peu propice à la biodiversité de la forêt. Cette dernière est pourtant un gage de résilience des forêts aux perturbations biotiques et climatiques. Ainsi, lorsque les conditions sont propices, par exemple dans le cas d’une large éclaircie au sein d’une forêt tropicale, il est largement préférable de laisser la place à une régénération naturelle. Celle-ci est généralement très favorable à la biodiversité et ne nécessite pas d’intervention humaine, synonyme d’émissions de gaz à effet de serre. En résumé, plutôt que de replanter, la priorité devrait donc souvent être donnée à la protection d’immenses régions forestières (en particulier dans les tropiques et en Russie), où les conditions d’humidité des sols sont favorables à la pousse des arbres (et à la régénération naturelle) et où les stocks de carbone diminuent par manque de protection. Si les grandes compagnies internationales veulent réellement investir d’une manière durable et désintéressée, c’est sans doute là que réside le meilleur choix.
7. Messages à retenir
- Les forêts représentent un immense stock de carbone via (i) la biomasse, (ii) le carbone du sol, (iii) le bois mort et (iv) la litière.
- Selon les régions, la forêt peut constituer une source ou un puits de carbone. La déforestation tropicale conduit à une émission importante de CO2 dans l’atmosphère, alors que la croissance des arbres contribue au contraire à capter le CO2 atmosphérique.
- Les forêts capteraient, selon les estimations, entre 70 et 100 % des 1,8 GtC/an absorbés au niveau des surfaces continentales. Les surfaces non forestières (prairies, cultures, toundra, etc.) capteraient entre 0 et 30 % de ces 1,8 GtC/an.
- La densité des stocks est similaire dans les forêts tropicales et boréales ; mais dans les forêts tropicales, les stocks se localisent principalement dans la biomasse (56 %) contre 32 % pour le sol ; vs 20 % et 60 % pour les forêts boréales.
- Sur un total de 360 GtC de biomasse vivante (aérienne et souterraine), les tropiques représentent environ 70 % (260 GtC) des stocks de carbone des forêts de la planète, dont à peu près 40 % (140 GtC) pour la seule partie tropicale américaine et 25 % (93 GtC) en considérant uniquement la biomasse aérienne vivante de l’Amazonie.
- Les forêts anciennes et intactes (essentiellement dans les forêts tropicales), constituent un puits de carbone, mais cet effet « puits » est probablement faible et en déclin du fait d’une mortalité croissante des arbres en lien avec à la sécheresse et l’augmentation des températures.
- De très nombreux facteurs peuvent être à l’origine d’une baisse des stocks de carbone de la forêt, comme la déforestation ou la dégradation des forêts. Ainsi, sur la dernière décennie, la partie brésilienne de l’Amazonie n’est plus un puits, mais une source de carbone.
- Les forêts de repousse constituent d’importants puits de carbone, mais les opérations de replantations sont une source de carbone très importante à cause de l’énergie dépensée pour la culture des plants, de l’utilisation d’engins mécaniques, de la construction de routes, etc.
- Lorsque les conditions sont propices, il est largement préférable de laisser la place à une régénération naturelle : celle-ci est généralement très favorable à la biodiversité et ne nécessite pas d’opérations de replantation.
- Plutôt que de replanter, la priorité devrait souvent être donnée à la protection d’immenses régions forestières (en particulier dans les tropiques et en Russie), où les conditions d’humidité des sols sont favorables à la pousse des arbres (et à la régénération naturelle) et où les stocks de carbone diminuent par manque de protection.
Cet article a initialement été publié en décembre 2021 par Planet Vie sous licence Creative Commons : Rôle des forêts dans le bilan de carbone de la planète. Il a été édité par M. Pascal Combemorel, Responsable éditorial du site Planet-Vie.
Notes et références
Image de couverture. Image par JoeBreuer de Pixabay.
[1] Qin Y., Xiao X., Wigneron J.-P. et al., Annual Maps of Forests in Australia from Analyses of Microwave and Optical Images with FAO Forest Definition, Journal of Remote Sensing, AAAS, 2021, Article ID 9784657, https://doi.org/10.34133/2021/9784657
[2] Friedlingstein, P., et al., Global Carbon Budget 2020, Earth Syst. Sci. Data, 12, 3269–3340, https://doi.org/10.5194/essd-12-3269-2020, 2020.
[3] Le Quéré, C. et al. Global Carbon Budget 2016. Earth Syst. Sci. Data 8, 605–649 (2016), https://doi.org/10.5194/essd-8-605-2016
[4] Houghton, R. A. & Nassikas, A. A. Global and regional fluxes of carbon from land use and land cover change 1850–2015. Glob. Biogeochem. Cycles 31, 456–472 (2017), https://doi.org/10.1002/2016GB005546
[5] Pan, Y. D. et al. A large and persistent carbon sink in the world’s forests. Science 333, 988–993 (2011), https://doi.org/10.1126/science.1201609
[6] Malhi Y. et al. (2006), The regional variation of aboveground live biomass in old-growth Amazonian forests. Global Change Biology, 12: 1107-1138. https://doi.org/10.1111/j.1365-2486.2006.01120.x
[7] Pugh T. et al., Role of forest regrowth in global carbon sink dynamics, Proc. Nat. Acad. Sci USA 116 (10) 4382-4387 (2019) https://doi.org/10.1073/pnas.1810512116
[8] Yang, H et al., Coarse woody debris is buffering mortality-induced carbon losses to the atmosphere in tropical forests, Environ. Res. Lett. 16 (2021) 011006, https://doi.org/10.1088/1748-9326/abd58a
[9] Luyssaert, S., Schulze, ED., Börner, A. et al. Old-growth forests as global carbon sinks. Nature 455, 213–215 (2008). https://doi.org/10.1038/nature07276
[10] Gundersen, P., Thybring, E.E., Nord-Larsen, T. et al. Old-growth forest carbon sinks overestimated. Nature 591, E21–E23 (2021). https://doi.org/10.1038/s41586-021-03266–
[11] Brienen, R. J. W. et al. Long-term decline of the Amazon carbon sink. Nature 519, 344–348 (2015). https://doi.org/10.1038/nature14283
[12] Hubau, W., Lewis, S.L., Phillips, O.L. et al. Asynchronous carbon sink saturation in African and Amazonian tropical forests. Nature 579, 80–87 (2020). https://doi.org/10.1038/s41586-020-2035-0
[13] Santoro, M. et al., The global forest above-ground biomass pool for 2010 estimated from high-resolution satellite observations, Earth Syst. Sci. Data, 13, 3927–3950, https://doi.org/10.5194/essd-13-3927-2021, 2021.
[14] Hansen, M. C., Potapov, P. & Tyukavina, A. Comment on ‘Tropical forests are a net carbon source based on aboveground measurements of gain and loss’. Science 363, eaar3629 (2019), https://doi.org/10.1126/science.aar3629
[15] Ygorra, B., Frappart F., Wigneron J.-P. et al., Monitoring loss of tropical forest cover from Sentinel-1 time-series: A CuSum-based approach, International Journal of Applied Earth Observations and Geoinformation 103 (2021) 102532, https://doi.org/10.1016/j.jag.2021.102532, 2021.
[16] Cobb, R. C., Haas, S. E., Kruskamp, N., Dillon, W. W., Swiecki, T. J., Rizzo, D. M., et al. (2020). The magnitude of regional-scale tree mortality caused by the invasive pathogen Phytophthora ramorum. Earth’s Future, 8, e2020EF001500. https://doi.org/10.1029/2020EF001500
[17] Wigneron, J.-P., L. Fan, P. Ciais et al., Tropical forests did not recover from the strong 2015-2016 El Niño event, Science Advances, vol. 6, no. 6, eaay4603, 2020, https://doi.org/10.1126/sciadv.aay4603
[18] Chave, J. et al. Improved allometric models to estimate the aboveground biomass of tropical trees. Glob. Chang. Biol. 20, 3177–3190 (2014).
[19] Baccini, A. et al., Tropical forests are a net carbon source based on aboveground measurements of gain and loss. Science 358, 230–234 (2017), https://doi.org/10.1126/science.aam5962
[20] Houghton, R. A. & Nassikas, A. A. Global and regional fluxes of carbon from land use and land cover change 1850–2015. Glob. Biogeochem. Cycles 31, 456–472 (2017), https://doi.org/10.1002/2016GB005546
[21] Hansen, M. C. et al. High-resolution global maps of 21st-century forest cover change. Science 342, 850–853 (2013). https://doi.org/10.1126/science.1244693
[22] Dubayah, R. et al. The Global Ecosystem Dynamics Investigation: high-resolution laser ranging of the Earth’s forests and topography. Sci. Remote Sens. 1, 100002 (2020), https://doi.org/10.1016/j.srs.2020.100002
[23] Baccini, A. et al. Estimated carbon dioxide emissions from tropical deforestation improved by carbon-density maps. Nat. Clim. Chang. 2, 182–185 (2012). https://doi.org/10.1038/nclimate1354
[24] Saatchi, S. S. et al. Benchmark map of forest carbon stocks in tropical regions across three continents. Proc. Natl Acad. Sci. USA 108, 9899–9904 (2011). https://doi.org/10.1073/pnas.1019576108
[25] Wigneron, J.-P., Li, X., et al., SMOS-IC data record of soil moisture and L-VOD: historical development, applications and perspectives, Remote Sens. Env., 254, 112238, https://doi.org/10.1016/j.rse.2020.112238, 2021.
[26] Tong, X., M. Brandt et al., Forest management in southern China generates short term extensive carbon sequestration, Nature Comm., 11:129, 2020, https://doi.org/10.1038/s41467-019-13798-8
[27] Cortés, J. et al., Where are global vegetation greening and browning trends significant? Geophysical Research Letters, 48, e2020GL091496. https://doi.org/10.1029/2020GL091496
[28] Mitchard, E.T.A. The tropical forest carbon cycle and climate change. Nature 559, 527–534 (2018). https://doi.org/10.1038/s41586-018-0300-2
[29] Fan, L., J.-P. Wigneron, P. Ciais et al., Satellite observed pantropical carbon dynamics, Nature Plants, 5, 944–951, July 2019, https://doi.org/10.1038/s41477-019-0478-9.
[30] Qin, Y. et al. (2021). Carbon loss from forest degradation exceeds that from deforestation in the Brazilian Amazon, Nature Climate Change, 11, 442–448, https://doi.org/10.1038/s41558-021-01026-5
[31] Urli, M., Lamy, JB., Sin, F. et al. The high vulnerability of Quercus robur to drought at its southern margin paves the way for Quercus ilex. Plant Ecol 216, 177–187 (2015). https://doi.org/10.1007/s11258-014-0426-8
[32] Tong, X., M. Brandt et al., Forest management in southern China generates short term extensive carbon sequestration, Nature Comm., 11:129, 2020, https://doi.org/10.1038/s41467-019-13798-8
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : WIGNERON Jean-Pierre, CIAIS Philippe (3 mai 2023), Rôle des forêts dans le bilan de carbone de la planète, Encyclopédie de l’Environnement. Consulté le 30 mars 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/role-forets-bilan-carbone/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







