Interaction rayonnement matière
PDF(Voir aussi le focus Aperçu sur la physique de l’effet de serre atmosphérique)
1. Absorption, émission
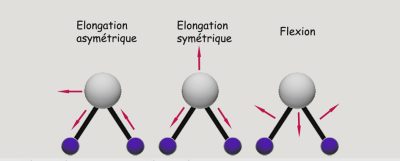
- la molécule dans son ensemble se déplace à une vitesse directement liée à la température, l’énergie correspondante est cinétique ;
- les électrons sont en mouvement autour des noyaux sur des orbites privilégiées, l’énergie est donc électronique ;
- les atomes qui constituent la molécule sont en mouvement les uns par rapport aux autres, on dit que la molécule vibre et l’énergie est de vibration (Figure 1) ;
- la molécule tourne sur elle-même, l’énergie est rotationnelle (Figure 2).
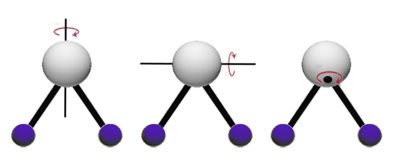
2. Absorption sélective, excitation
Un photon est absorbé quand son énergie ![]() où
où ![]() est la fréquence de l’onde associée permet à une molécule de passer d’un mode donné à un autre. La molécule étant dans l’état d’énergie
est la fréquence de l’onde associée permet à une molécule de passer d’un mode donné à un autre. La molécule étant dans l’état d’énergie ![]() cela se produit quand il existe pour elle un état d’énergie
cela se produit quand il existe pour elle un état d’énergie ![]() , tel que
, tel que
![]() . La molécule est alors dans un état excité, elle ne le reste jamais bien longtemps. L’ordre de grandeur de la durée de vie des états de vibration excités est voisin de
. La molécule est alors dans un état excité, elle ne le reste jamais bien longtemps. L’ordre de grandeur de la durée de vie des états de vibration excités est voisin de ![]()
3. Désexcitation
Elle peut se désexciter de deux manières : soit en émettant spontanément un photon de même énergie, on parle alors de désexcitation radiative soit en passant au voisinage d’une autre molécule, à une distance telle que leurs dipôles électriques interagissent. Dans ce dernier cas, l’énergie supplémentaire est transformée en énergie cinétique, c’est ce qu’on appelle une collision. Le processus inverse transforme de l’énergie cinétique en énergie radiative quand les interactions entre deux molécules proches provoquent une transition vers un état plus énergétique, la molécule étant alors excitée par collision. Au bout d’un temps très court, elle est, à son tour désexcitée par l’un des deux processus et ainsi de suite. L’absorption de rayonnement augmente l’énergie cinétique moyenne et donc la température, l’émission aboutit au phénomène inverse.
4. Durée de vie de l’état excité
Le temps pendant lequel la molécule reste dans l’état excité s’appelle la durée de vie de l’état excité. Dans le cas de la désexcitation radiative, c’est-à-dire par émission spontanée, on parle aussi de durée de vie naturelle. Elle peut alors être déterminée à partir du coefficient d’absorption ou du coefficient d’Einstein [1] d’émission spontanée. Pour les collisions, la durée de vie dépend de la densité de molécules et de leur agitation, c’est à dire de la pression et de la température.
5. Hiérarchie des différents types de transitions
Les transitions entre les niveaux électroniques ![]() sont les plus énergétiques, la fréquence
sont les plus énergétiques, la fréquence ![]() de la transition se situe dans l’UV ou le visible, les transitions entre états de vibration
de la transition se situe dans l’UV ou le visible, les transitions entre états de vibration ![]() sont situées dans le proche IR, les transitions d’un état de rotation à un autre
sont situées dans le proche IR, les transitions d’un état de rotation à un autre ![]() sont les moins énergétiques et se situent dans l’IR et les micro-ondes. Lors d’une collision, une molécule peut subir en même temps les trois types de transition, de même si elle interagit avec un photon de fréquence
sont les moins énergétiques et se situent dans l’IR et les micro-ondes. Lors d’une collision, une molécule peut subir en même temps les trois types de transition, de même si elle interagit avec un photon de fréquence ![]() tel que
tel que ![]() est une combinaison de
est une combinaison de ![]()
6. Équilibre thermodynamique local (ETL)
Pour un gaz dans une enceinte fermée, à température constante ce qui définit l’équilibre thermodynamique strict, les différents niveaux d’énergie possibles sont peuplés suivant la loi statistique de Boltzmann [2], l’émission suit la loi de Planck (Voir focus La théorie de Planck) et le champ de rayonnement est uniforme. Dans l’atmosphère, la température n’est pas constante mais l’agitation moléculaire assure le peuplement des niveaux d’énergie suivant la loi de Boltzmann [3] jusque des altitudes élevées, variables suivant les transitions mais typiquement de l’ordre de 40 à 50 km. Dans ce cas qu’on nomme Équilibre Thermodynamique Local (ETL), le champ de rayonnement diffère de celui du corps noir (c’est-à-dire, le rayonnement n’est pas uniforme) mais les molécules émettent suivant la loi de Planck.
Pour mettre en défaut l’ETL, il faut s’intéresser à l’absorption ou à l’émission par les plus hautes couches de l’atmosphère (en pratique dans la mésosphère, au-dessus de 50km pour certaines transitions de certains gaz et généralement bien plus). On observe l’effet des écarts à l’ETL lorsqu’on examine les spectres d’absorption mesurés depuis satellite lors d’observation au limbe, c’est à dire tangentiellement à l’atmosphère ce qui permet d’en sonder les couches les plus externes, comme avec l’instrument MIPAS [4] sur le satellite ENVISAT [5].
Notes et références
Vignette du focus. Extrait de la figure 2 du focus, © figure de l’auteur.
[1] https://fr.wikipedia.org/wiki/Coefficients_d%27Einstein
[2] Ne jamais perdre de vue que le nombre de molécules à considérer est très élevé. Typiquement aux conditions standards de pression et température, il y a 6,02 1023 molécules pour 22,4 l (nombre d’Avogadro) ou 2,68 1019 molécules par cm3. Pour le gaz carbonique cela fait encore 1.1016 molécules par cm3. Toutes ces molécules se répartissent sur les différents niveaux d’énergie possibles, c’est la distribution statistique de cette répartition qui dépend de la température via la loi de Boltzmann.
[3] https://fr.wikipedia.org/wiki/Statistique_de_Maxwell-Boltzmann
[4] https://earth.esa.int/eogateway/instruments/mipas/description




