Radioactivité et réactions nucléaires
PDF
Pour que le noyau d’un atome soit stable, il lui faut une certaine proportion de neutrons et de protons. Sinon, il subit une série de désintégrations pour rejoindre un état stable en évacuant les particules en excès. Ce faisant, il émet des rayonnements qui, à forte dose, attaquent les tissus vivants non protégés. Chaque noyau radioactif est caractérisé par la nature et l’énergie des rayonnements qu’il émet et son rythme spécifique de désintégration.
1. Des noyaux stables aux noyaux radioactifs.

Le noyau est un assemblage de particules massives, les nucléons : la masse d’un nucléon est plus de 1800 fois la masse d’un électron. Les nucléons se répartissent entre les protons qui portent une charge électrique positive et les neutrons qui ne sont pas chargés. Le nombre de protons d’un noyau détermine son espèce chimique (1 proton = hydrogène, 2 = hélium, 6 = carbone, etc.). On note A, le nombre de nucléons ou masse atomique, et Z, le nombre de protons ou numéro atomique. Les atomes de même Z dont les nombres A diffèrent sont des isotopes d’un même élément. Leurs propriétés chimiques (liées aux protons) sont presque identiques, mais leurs propriétés nucléaires peuvent être très différentes. On note couramment les isotopes par leur symbole chimique précédé de leur masse atomique en exposant : 1H, 4He, 12C, 16O, 235U…
Les électrons sont répartis sur des couches plus ou moins éloignées du noyau. Les électrons périphériques jouent un rôle principal dans les réactions chimiques. Dans une molécule, les atomes mettent plus ou moins en commun ces électrons périphériques. Un atome possède le même nombre de protons et d’électrons : il est électriquement neutre. Si les deux nombres diffèrent, l’atome est dit ionisé – mais il garde la nature chimique déterminée par ses protons. S’il a un excès d’électrons, c’est un ion négatif, ou anion (exemple : Cl–, O—), dans le cas contraire, c’est un ion positif, ou cation (exemple H+, Ca++).
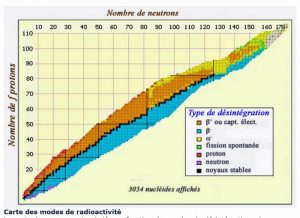
Dans le noyau, les neutrons assurent la cohésion des protons qui, sans eux, se repousseraient mutuellement, ayant une charge électrique identique. Plus un noyau comporte de nucléons, plus il faut que le nombre de neutrons excède celui des protons pour que l’assemblage reste stable : c’est ainsi que les noyaux d’atomes présents dans la nature se situent dans ce qu’on appelle la « vallée de stabilité » sur un diagramme comparant le nombre de protons et le nombre de neutrons des noyaux (Figure 2).
Si un noyau a trop, ou pas assez de neutrons, il est instable, et tendra à rejoindre, plus ou moins vite, la vallée de stabilité, en se désintégrant selon un des mécanismes décrits au chapitre suivant. Cette désintégration s’accompagne d’une émission d’énergie et de rayonnements : c’est ce qu’on appelle la radioactivité.
On oppose souvent radioactivité naturelle et radioactivité artificielle : c’est un abus de langage, il n’y a qu’une radioactivité, mais elle peut venir de noyaux présents naturellement sur Terre (et notamment dans le corps humain qui contient naturellement du potassium 40K, et du carbone 14C ou de noyaux fabriqués artificiellement dans des accélérateurs de particules ou des réacteurs nucléaires. Les éléments radioactifs naturels peuvent être issus directement de la nucléosynthèse dans les étoiles et les supernovæ, comme le potassium 40K et l’uranium 238U. Ils peuvent aussi être formés lors d’interaction de noyaux préexistants avec des particules du rayonnement cosmique, comme le carbone 14C. Ils peuvent enfin provenir de la désintégration d’un autre noyau radioactif, comme le radium, descendant de l’uranium.
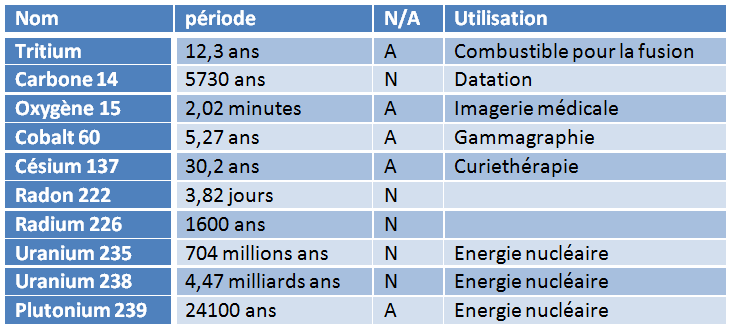
Chaque isotope radioactif – on dit aussi radionucléide – est caractérisé par le rythme de sa désintégration. On appelle période, ou parfois demi-vie, et on note T½, la durée au bout de laquelle exactement la moitié d’un nombre donné de noyaux se sera désintégré. La période est une donnée statistique : il est impossible de prédire à quel moment un noyau radioactif individuel se désintégrera, mais si on part d’un milliard de ces noyaux, on connaît avec une extrême précision quand il n’en restera plus que 500 millions. Et cette période caractéristique d’un noyau précis peut aller d’une fraction de milliseconde à quelques milliards d’années… (voir tableau 1).
Tableau 1 : Quelques atomes radioactifs (N=naturel, A=artificiel)
Dans les médias, la période est souvent appelée « durée de vie » et les commentaires associés laissent entendre que plus longue est sa durée de vie, plus un atome radioactif est dangereux… C’est exactement l’inverse : si la période est longue, c’est que le rythme de désintégration est lent, et donc que l’activité est faible !
2. Rayonnements, activité, doses
Un atome radioactif tend à revenir dans la vallée de stabilité en émettant des rayonnements. Cela peut se produire de différentes façons illustrées sur la Figure 3.
2.1. Rayonnement ALPHA (α)
Si son noyau est instable parce qu’il comporte un excès de nucléons, ce qui est le cas de beaucoup de noyaux lourds, l’atome radioactif se désintégrera en éjectant un assemblage de deux protons et deux neutrons, ce qu’on appelle une particule α et qui constitue un noyau d’hélium. Ce faisant, l’atome recule de deux numéros atomiques et sa masse atomique diminue de 4 : le plutonium 239Pu devient donc uranium 235U et l’uranium 235U devient thorium 231Th, par exemple.
2.2. Rayonnement BETA- (β–)
Si l’atome radioactif est instable parce que son noyau a trop de neutrons, un neutron se transformera en proton, en éjectant un électron, pour garder l’équilibre électrique, ainsi qu’une particule infime appelée antineutrino (noté \overline{\nu}). A masse atomique inchangée, l’atome gagne un numéro atomique. C’est ainsi que l’iode 135I devient xénon 135Xe ou le neptunium 239Np devient plutonium 239Pu : c’est la radioactivité β–.
2.3. Rayonnement BETA+ (β+)

2.4. Rayonnement GAMMA (γ)
Même avec le nombre correct de nucléons, un noyau peut être excité et devoir se débarrasser d’un trop-plein d’énergie : il le fait en émettant un rayonnement électromagnétique de très courte longueur d’onde, un photon γ (Lire « Les couleurs du ciel »). Une désintégration β est souvent associée à un rayonnement γ.
Il y a des formes plus rares de radioactivité, correspondant, par exemple, à l’émission d’un neutron (lire article « Maîtriser l’énergie nucléaire », section « neutrons retardés »).
Après une désintégration, l’atome résultant peut, lui aussi,être instable et se désintégrer à son tour : il se produit une « chaîne » de désintégrations qui ne s’arrête que quand on atteint la stabilité. C’est ainsi qu’à l’issue de 16 désintégrations successives, l‘uranium 238U devient le plomb 208Pb qui est stable.
2.5. Les unités en radioactivité
L’activité d’un atome radioactif est le rythme de sa désintégration. Elle s’exprime en becquerel (Bq) : 1 Bq = 1 désintégration par seconde. Le becquerel est une unité très petite : la radioactivité naturelle du corps humain, mentionnée au chapitre précédent, est ainsi d’environ 8000 Bq. Pas de quoi devoir porter un manteau de plomb pour ne pas irradier ses voisins ! C’est pourquoi l’activité d’une source radioactive s’exprime souvent en giga (milliards), voire en téra-becquerels (mille milliards) que l’on note GBq et TBq. L’activité est une mesure de rythme, mais pas une mesure d’effet : si on vous bombarde au même rythme avec des balles de ping-pong ou avec des boules de pétanque, ça ne vous fera pas le même effet ! D’où la notion de dose.
Quand un rayonnement rencontre une matière, il perd progressivement tout ou partie de son énergie, celle-ci étant absorbée par la matière. On appelle dose la quantité d’énergie d’un rayonnement absorbée par une masse donnée de matière. La dose se mesure en gray (Gy) : 1 Gy = 1 joule/kg. Contrairement au becquerel, le gray est une unité très grande, dont on utilise surtout les sous-multiples microgray (millionième) ou milligray (millième de Gray).
Dans les tissus vivants (voir ci-dessous), les dommages causés par les rayonnements ne dépendent pas que de la dose : ils sont aussi fonction de la nature du rayonnement considéré, et de la nature du tissu irradié. Si la dose est une grandeur physique, la dose équivalente est une grandeur biologique qui tient compte de ces paramètres supplémentaires en multipliant le nombre de grays par les coefficients adéquats. Elle s’exprime en sievert (Sv), plus souvent en milli- ou microsieverts (mSv, μSv).
Le débit de dose mesure la dose absorbée par unité de temps (exemples : μSv/h, mSv/an, etc.)
3. Les effets des rayonnements sur le vivant
3.1. Comment s’en protéger
La radioactivité fait peur parce que les rayonnements ne sont pas perceptibles par nos sens – ils sont invisibles, inodores et silencieux – et parce que les fortes doses peuvent provoquer des cancers.
Si les rayonnements échappent effectivement à nos sens, ils sont, en revanche, facilement détectables à des doses infimes : quand on pratique un examen « PET » [2], on enregistre chaque désintégration individuelle ! Par comparaison, aucun de nos instruments ne pourrait détecter moins de quelques milliards de milliards de molécules d’un poison chimique !

- Une feuille de papier à cigarette, la petite couche de cellules mortes de notre épiderme suffisent à arrêter les rayons alpha.
- Quelques millimètres de tôle d’aluminium permettent de bloquer les rayons bêta.
- 1,5 mètres de béton, ou 5 mètres d’eau arrêteront les gammas et les neutrons.

3.2. Effets biologiques des rayonnements
Du fait de leur grande énergie, les rayonnements issus de la radioactivité sont capables d’ioniser les atomes (en extraire des électrons) lorsqu’ils pénètrent dans la matière. C’est pourquoi on les classe parmi les « rayonnements ionisants », par opposition à la lumière visible et aux rayonnements électromagnétiques de plus grande longueur d’onde (lire « Les couleurs du ciel »). Cette ionisation peut casser les molécules et provoquer des réactions chimiques. Les rayons cosmiques, particules énergétiques émises par le Soleil ou par des sources plus lointaines, sont également des rayonnements ionisants, de même que les rayons X utilisés en imagerie médicale.
La plupart des molécules de notre organisme sont régénérées en permanence et de tels effets sont alors réversibles. L’ADN de nos cellules joue cependant un rôle particulier en portant la mémoire de notre patrimoine génétique, et sa préservation est donc essentielle. L’ADN est une énorme molécule qui comporte des milliards d’atomes arrangés sur deux brins enroulés en double hélice : les rayonnements ionisants peuvent y causer des dégâts en endommageant un des brins ou, pire, les deux à la fois.
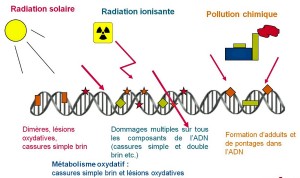
Autant dire que nos mécanismes de réparation sont d’une efficacité et d’une rapidité extrême. Par comparaison, la radioactivité naturelle dans laquelle nous baignons occasionne de l’ordre de quelques attaques par cellule et par an.

On voit qu’il est possible qu’une seule irradiation provoque un cancer, mais que la probabilité en est extrêmement faible.
3.3. Les règles internationales de radioprotection
Créé en 1955, le Comité Scientifique des Nations Unies sur les effets des rayonnements atomiques (UNSCEAR) établit périodiquement des synthèses de l’ensemble des données scientifiques internationales dans son domaine de compétence [4]. Depuis sa création, l’UNSCEAR a fait des études épidémiologiques sur des « cohortes », groupes d’individus ayant subi des irradiations ou contaminations significatives : survivants d’Hiroshima et Nagasaki, travailleurs du complexe soviétique de Mayak, populations riveraines de la rivière Tetcha, voisins du site d’explosions atomiques aériennes de Semipalatinsk, le personnel américain en radiologie, le personnel navigant aérien (soumis pendant ses vols au rayonnement cosmique), etc. C’est sur la base de ces études que sont établies les règles de radioprotection, c’est-à-dire de protection du public et des travailleurs contre la radioactivité. En résumé, les effets des rayonnements sont d’abord fonction de la dose reçue, mais aussi du « débit de dose » qui caractérise l’intensité de cette dose.
3.4. Fortes doses
- Si une personne reçoit des doses fortes (au dessus de 1 Sv) les morts cellulaires sont nombreuses et les effets, visibles : des lésions apparaissent sur la peau, le sang, l’intestin… ces lésions sont d’autant plus graves que la dose reçue est élevée. On parle d’effet déterministe, et de « syndrome d’irradiation aiguë ».
- En outre, si un groupe de personnes reçoit des fortes doses, il apparaît plus de cancers dans ce groupe de personnes que s’il n’avait pas été irradié. La fréquence varie avec la dose, mais la gravité n’en dépend pas. Cet effet qui varie d’un individu à l’autre est appelé « stochastique », synonyme d’aléatoire.
3.5. Faibles doses
Si les dégâts créés par les fortes doses sont manifestes, le domaine des faibles doses est encore assez flou. D’une part, les cancers ont bien d’autres sources que les rayonnements ionisants, et d’autre part les faibles doses se perdent dans le bruit de fond des variations de la radioactivité naturelle. De plus, il est très difficile de trouver des cohortes dont les individus ne diffèrent que par la dose reçue : par exemple, il faudrait des doses très significatives pour amener le risque de cancer d’un non fumeur au niveau du risque d’un fumeur ! On peut néanmoins dire ceci :
- En dessous de 100 mSv (0,1 Sv) aucune observation d’une augmentation du nombre de cancers n’a été observée, mais si les populations irradiées et observées étaient plus grandes on aurait peut-être pu en constater.
- C’est pourquoi la Commission Internationale de Protection Radiologique CIPR, pour déterminer les limites de doses, extrapole linéairement aux faibles doses ce que l’on constate aux fortes doses. Cette hypothèse de « relation linéaire sans seuil » est conservative et utilisée suivant le principe de précaution pour fixer les règles de radioprotection. Elle peut conduire à surestimer l’incidence moyenne en ignorant de possibles effets de seuil : les mécanismes de réparation évoqués plus haut peuvent être plus efficaces à faible dose mais « saturer » à forte dose. Par ailleurs la dose collective dans un groupe de personnes peut recouvrir de fortes variations individuelles, et le nombre de cancers apparaissant présente des fluctuations aléatoires inhérentes à de tels évènements rares : ce nombre ne s’approche de la moyenne qu’au-delà d’une centaine de cas.

Par comparaison, la dose due à l’irradiation naturelle en France varie entre 2,4 et 10 mSv/an, et dans certaines régions du monde au sol particulièrement radioactif, la dose naturelle peut dépasser 100 mSv/an. Le Français moyen reçoit aussi une dose de 1 mSv/an en radiographies médicales et dentaires. La Figure 8 représente l’irradiation moyenne d’un habitant du bassin parisien.
3.6. La contamination

Une contamination interne se produit de trois façons : par l’inhalation de substances ou poussières radioactives ; par ingestion, lorsqu’elles sont contenues dans les aliments absorbés ou bien déposées sur un objet porté à la bouche ; par blessure avec un objet contaminé ou lorsqu’elles souillent une plaie existante. Il est très difficile [5] de décontaminer une personne ayant subi une contamination interne. On peut par contre en limiter parfois l’effet, par exemple dans le cas du tritium, en buvant beaucoup d’eau.
Les travailleurs du nucléaire se protègent d’une contamination en portant des vêtements spéciaux, des gants et des masques (qui deviendront des déchets radioactifs). On assure l’étanchéité des pièces où se trouvent les substances radioactives, ainsi que le renouvellement de l’air des locaux qui est filtré pour piéger les poussières radioactives. Les manipulations d’objets très radioactifs se font avec des télémanipulateurs à travers un blindage ou, parfois, avec des robots.

On ne peut clore ce chapitre sans rappeler les applications médicales des rayonnements, à très fortes doses : radiothérapie et curiethérapie. Les rayonnements ont guéri beaucoup plus de cancers qu’ils n’en ont causés.
Références et notes
Image de couverture : Pierre et Marie Curie, lauréats avec Henri Becquerel du prix Nobel de Physique en 1903 pour la découverte de la radioactivité.
[1] Il existe un quatrième état de la matière : le plasma, qui constitue 99% de l’univers. Dans le plasma, il n’y a pas d’atomes : les noyaux « nagent » dans une mer d’électrons.
[2] Imagerie médicale par tomographie électron-positon (Positon Electron Tomography), qui permet, par exemple, de montrer les zones du cerveau activées par une activité donnée.
[3] Par exemple, dans la formation de la main, ce ne sont pas les doigts qui poussent, mais les espaces entre les doigts qui se suicident…
[4] On trouvera une synthèse en français de rapport UNSCEAR dans le rapport IRSN 2006-74
[5] Il est possible, par exemple d’éliminer des particules de plutonium inhalées par lavage du poumon avec un agent chélateur (molécule spéciale en forme de pince), mais c’est une procédure très lourde.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : BARRÉ Bertrand (27 juin 2018), Radioactivité et réactions nucléaires, Encyclopédie de l’Environnement. Consulté le 21 décembre 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/physique/radioactivite-reactions-nucleaires/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.