Antibiotiques, antibiorésistance et environnement
PDF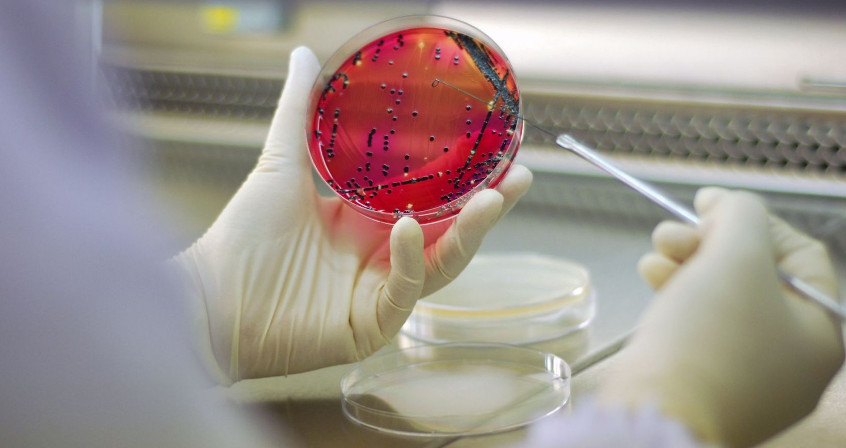
Les microorganismes produisent naturellement des antibiotiques qui inhibent la croissance d’autres microorganismes compétiteurs. Pour survivre, ils développent des mécanismes génétiques et biochimiques de résistance aux antibiotiques, qui ont largement diffusé entre espèces du fait de leurs échanges génétiques fréquents. Or depuis les années 1940, l’homme a développé de nouveaux antibiotiques et leur utilisation est devenue massive : en 15 ans la consommation mondiale d’antibiotiques a augmenté de 65%, principalement dans les pays à revenu intermédiaire ou faible. Ce phénomène planétaire représente aujourd’hui une préoccupation majeure en santé publique. Certaines bactéries pathogènes pour l’homme et les animaux sont devenues résistantes à la plupart des molécules antibiotiques développées par l’industrie pharmaceutique. De plus, les antibiotiques administrés à l’homme et aux animaux, et les bactéries résistantes sélectionnées chez ces hôtes, ont été largement disséminés dans l’environnement. Les bactéries ont évolué elles aussi vers une augmentation de leurs capacités d’antibiorésistance. Il existe des échanges permanents entre les flores bactériennes de réservoir environnemental, animal ou humain. La lutte contre l’antibiorésistance doit donc être envisagée de façon globale. Ne devrait-elle pas prendre en compte les effets des antibiotiques sur ces différents réservoirs ?
- 1. L’antibiorésistance chez les bactéries : Une menace sanitaire mondiale
- 2. L’environnement : ancien réservoir d’antibiorésistance
- 3. Dissémination des antibiotiques produits par l’homme dans l’environnement
- 4. Dissémination des nouveaux gènes d’antibiorésistance d’origine humaine et animale dans l’environnement
- 5. Émergence de nouvelles résistantes aux antibiotiques dans l’environnement
- 6. L’environnement comme source de nouvelles antibiorésistances chez l’homme et les animaux
- 7. Synthèse et perspectives : Mieux appréhender les risques liés à l’environnement et à l’élevage intensif
- 8. Messages à retenir
1. L’antibiorésistance chez les bactéries : Une menace sanitaire mondiale
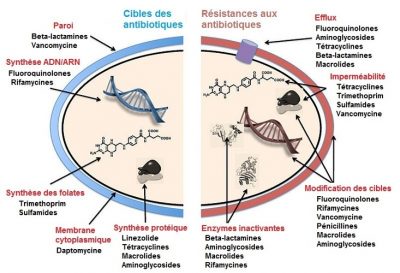
- l’imperméabilité de la membrane bactérienne à cet antibiotique ;
- l’efflux de l’antibiotique hors de la bactérie après pénétration ;
- la réduction de l’affinité de l’antibiotique pour sa ou ses cibles bactériennes, par modification quantitative ou qualitative de celles-ci ;
- et l’inactivation de l’antibiotique par des enzymes bactériennes.
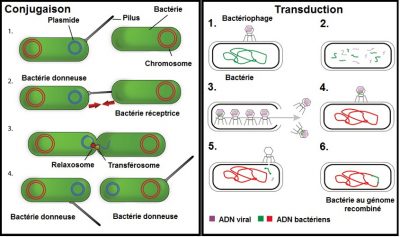
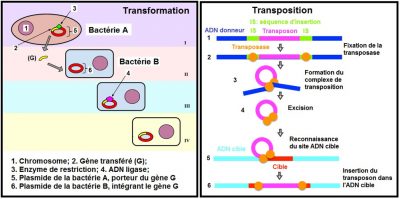
Chez certaines espèces bactériennes, ces mécanismes d’antibiorésistance sont stables et concernent la majorité des souches : on parle d’antibiorésistance naturelle. Au contraire, on parle d’antibiorésistance acquise lorsque certaines souches d’une espèce bactérienne habituellement sensible à un antibiotique acquièrent un mécanisme génétique de résistance à celui-ci. L’acquisition de nouvelles résistances antibiotiques peut être liée à des mutations (Lire Polymorphisme génétique et variation) affectant les propriétés ou le niveau d’expression des gènes de résistance. Elle peut être également la conséquence de l’acquisition de nouveaux gènes de résistance. En effet, des éléments génétiques mobiles [1] (plasmides, transposons, intégrons, etc.) peuvent être échangés entre bactéries de même espèce ou d’espèces différentes. Ces échanges ont lieu grâce à des mécanismes de transferts horizontaux de gènes [2] (conjugaison, transformation, transduction, transposition) (Figures 2 et 3). L’ensemble des gènes de résistance aux antibiotiques présents chez les microorganismes pathogènes ou non constitue le résistome.

L’antibiorésistance est actuellement un problème majeur de santé publique à l’échelle mondiale, qui a nécessité l’élaboration de plans de lutte internationaux (OMS notamment) et nationaux. Si les réservoirs humain et animaux de ces résistances aux antibiotiques sont bien caractérisés, le rôle de l’environnemental dans leur émergence et leur diffusion n’a été reconnu que récemment.
2. L’environnement : ancien réservoir d’antibiorésistance
De nombreux microorganismes environnementaux (plus particulièrement des bactéries et des champignons ou micromycètes) produisent naturellement des antibiotiques, qui leur confèrent un avantage sélectif de croissance vis-à-vis des autres espèces environnementales. Ces microorganismes possèdent des gènes codant pour des mécanismes de résistance aux antibiotiques qu’ils produisent, et transmettent ces gènes à leur descendance (transmission verticale) [4]. Les microorganismes non producteurs d’antibiotiques peuvent également héberger naturellement des gènes d’antibiorésistance ou les acquérir de novo. Chez les bactéries, les échanges génétiques sont nombreux, entre individus d’une même espèce ou d’espèces différentes (transmission horizontale). Ce phénomène de dissémination de l’antibiorésistance dans l’environnement est vraisemblablement très ancien (plusieurs milliards d’années) et se poursuit de nos jours [5]. Ces résistances peuvent être transmises des bactéries environnementales à celles qui colonisent l’homme et les animaux. On peut citer comme exemples l’émergence récente de bêta-lactamases à spectre étendu (BLSE) de type CTX-M ou un nouveau mécanisme de résistance aux fluoroquinolones (gènes qnr) [6].
3. Dissémination des antibiotiques produits par l’homme dans l’environnement
Le début du XXe siècle a été marqué par la découverte et surtout la production en masse d’antibiotiques naturels (extraits de microorganismes producteurs de ces molécules) ou obtenus par synthèse chimique. Parmi les antibiotiques naturels, on peut citer les bêta-lactamines (notamment la pénicilline), les aminoglycosides, les tétracyclines, et les macrolides. La plupart de ces molécules naturelles ont été modifiées chimiquement pour devenir des antibiotiques semi-synthétiques, puis plus récemment synthétiques. Les sulfamides et les quinolones sont des molécules synthétisées d’emblée par l’homme. A partir des années 1940, l’utilisation des antibiotiques chez l’homme et les animaux a augmenté de façon exponentielle, correspondant au relargage de millions de tonnes d’antibiotiques dans l’environnement. Trois sources principales de pollution de l’environnement par les antibiotiques existent :
- les usines de production industrielle des antibiotiques qui dispersent une partie de cette production dans leur environnement aquatique ;
- les élevages d’animaux domestiques traités par des antibiotiques ;
- les humains qui reçoivent des antibiotiques.
3.1. Usines de production des antibiotiques
Les usines de production des antibiotiques disséminent dans leurs effluents des quantités importantes d’antibiotiques. Les contraintes règlementaires actuelles en terme de pollution environnementale sont insuffisantes dans les pays produisant de grandes quantités d’antibiotiques, notamment en Europe, aux États-Unis, en Chine et en Inde. Des concentrations d’antibiotiques pouvant dépasser 1 mg/L ont été détectées dans des effluents de certaines usines de production [7]. Ces concentrations ont un impact majeur sur la flore microbienne environnementale. De plus, ces antibiotiques se répandent largement dans l’environnement et polluent les eaux souterraines.
3.2. Utilisation vétérinaire des antibiotiques
L’utilisation des antibiotiques chez les animaux domestiques (ceux sauvages sont rarement concernés) représente environ 60% de la production totale d’antibiotiques et continue d’augmenter [8]. Plus de 100 000 tonnes d’antibiotiques sont administrées annuellement dans le monde au bétail, aux animaux de basse cours et en aquaculture [9]. Les tétracyclines surtout, suivies des pénicillines et des sulfamides sont les antibiotiques les plus utilisés. Cependant, les bêta-lactamines, les aminoglycosides, les phénicolés, les macrolides et les glycopeptides sont également concernés. Les antibiotiques utilisés chez l’homme et les animaux appartiennent aux mêmes familles et sont donc inactivés par les mêmes mécanismes d’antibiorésistance. Les antibiotiques sont administrés aux animaux domestiques pour traiter les maladies infectieuses, pour les prévenir (antibioprophylaxie), ou comme suppléments alimentaires. Concernant le traitement et la prophylaxie des infections bactériennes, les antibiotiques sont souvent dispensés dans l’eau de boisson ou les aliments à l’ensemble de l’élevage, même si quelques animaux seulement sont malades. L’utilisation systématique des antibiotiques comme suppléments alimentaires (bétail surtout, volailles, poissons, etc.) a pour but d’améliorer la productivité des élevages (en termes de quantité de viande produite par exemple).
Cette utilisation des antibiotiques à des fins de rentabilité a été largement majoritaire pendant plusieurs décennies. Elle est actuellement interdite en Europe mais son utilisation persiste dans de nombreux pays. En effet, elle est reconnue comme cause majeure d’émergence d’antibiorésistance chez les bactéries (ex. Escherichia coli) colonisant le tube digestif de ces animaux. La plupart des bactéries résistantes sélectionnées chez ces animaux peuvent être ensuite transmises à l’homme à leur contact ou par l’intermédiaire des produits alimentaires contaminés. De plus, les antibiotiques administrés aux animaux sont présents sous forme active dans leurs excréments. Les eaux usées provenant de ces élevages sont souvent éliminées directement dans l’environnement aquatique ou utilisées pour irriguer les cultures sans traitement préalable.
3.3. Utilisation des antibiotiques chez l’homme
Les antibiotiques sont utilisés chez l’homme, soit pour traiter les maladies infectieuses, soit pour les prévenir (antibioprophylaxie). La consommation humaine globale d’antibiotiques correspond à plusieurs dizaines de milliards de doses unitaires chaque année. Les bêta-lactamines (pénicillines, céphalosporines, carbapénèmes) sont actuellement les antibiotiques les plus utilisés (environ 60% de la consommation humaine). L’utilisation des tétracyclines, des macrolides et des fluoroquinolones est également élevée. Environ 80% des antibiotiques sont utilisés en traitement communautaire et 20% en milieu hospitalier. Cependant, le rôle des établissements de soins dans la dissémination des résistances bactériennes est majeur du fait du large spectre des antibiotiques utilisés et du risque élevé de transmission interhumaine des bactéries résistantes sélectionnées [10]. Une partie des antibiotiques prescrits aux personnes infectées n’est pas utilisée et donc rejetée avec nos déchets quotidiens dans l’environnement.
De façon plus significative, la plupart des antibiotiques absorbés par l’homme sont éliminés sous forme active dans les urines et les fèces. Dans les pays en voie de développement, ces antibiotiques sont directement dispersés dans l’environnement hydro-tellurique. Dans les pays possédant des infrastructures de traitement des eaux usées, une grande partie de ces antibiotiques est retrouvée au niveau des stations d’épuration de ces eaux [11]. Des concentrations de l’ordre du µg/L d’antibiotiques (bêta-lactamines, macrolides, tétracyclines, fluoroquinolones, etc.) ont été détectées dans des eaux usées de certaines stations d’épuration. Ces antibiotiques sont biodégradés, absorbés au niveau des boues d’épuration, ou éliminés inchangés dans les effluents de la station. Les boues d’épuration peuvent être utilisées comme engrais dans les champs de culture, alors que les effluents sont rejetés en milieu aquatique (rivières). Dans les deux cas, il s’ensuit une dissémination des antibiotiques actifs dans l’environnement hydro-tellurique.
- Concentrations résiduelles des antibiotiques dans l’environnement
Les antibiotiques sont détectés dans certains environnements aquatiques et telluriques à des concentrations variant du ng au µg par litre d’eau ou par gramme de sol. Des concentrations semblables ont également été mesurées dans certaines eaux souterraines. Ces antibiotiques persistent dans l’environnement après contamination pendant des durées pouvant varier de quelques jours (ex. les bêta-lactamines) à plusieurs mois (ex. les fluoroquinolones et les tétracyclines). Pour ces dernières molécules, il existe donc un phénomène d’accumulation si la contamination environnementale est permanente ou fréquente. Des résidus d’antibiotiques peuvent également être détectés en milieu marin. Enfin, des concentrations résiduelles d’antibiotiques de l’ordre du ng/L ont été parfois détectées dans l’eau potable.
4. Dissémination des nouveaux gènes d’antibiorésistance d’origine humaine et animale dans l’environnement
Les antibiotiques administrés aux humains et aux animaux sélectionnent dans leur flore commensale (leur microbiote) les espèces et souches bactériennes les plus résistantes à ces molécules (Lire Les microbiotes humains : des alliés pour notre santé).
Les antibiotiques favorisent également les mutations géniques et les transferts horizontaux de gènes codant pour l’antibiorésistance par induction des systèmes SOS bactériens. Ce phénomène est particulièrement important au niveau du microbiote intestinal, riche et contenant plusieurs milliers d’espèces bactériennes (Figure 4).
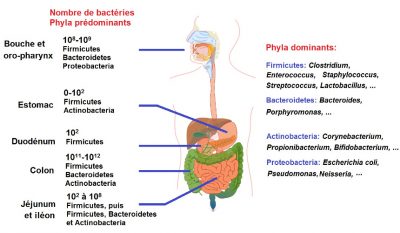
5. Émergence de nouvelles résistantes aux antibiotiques dans l’environnement
L’environnement hydro-tellurique est un milieu riche en microorganismes dont la diversité n’est que partiellement caractérisée. Concernant les bactéries, les études métagénomiques récentes ont permis de découvrir de nombreuses nouvelles espèces. Elles ont montré également que plus de 99% des espèces bactériennes environnementales ne sont pas cultivables avec les méthodes actuelles [12].
Cet environnement est de plus en plus pollué par des bactéries résistantes aux antibiotiques d’origine humaine ou animale, par les gènes codant pour ces résistances, et par les antibiotiques produits par l’homme. Les végétaux absorbent une partie de ces antibiotiques, en particulier au niveau des cultures irriguées avec de l’eau ou enrichies avec des boues de stations d’épuration contaminées par ces molécules. Si les concentrations résiduelles d’antibiotiques dans l’environnement sont habituellement faibles, elles exercent néanmoins une pression de sélection progressivement croissante sur la flore microbienne naturelle. Cette pression de sélection favorise les échanges horizontaux de gènes d’antibiorésistance entre espèces naturelles et espèces polluantes, en particulier au niveau des populations bactériennes riches et variées situées dans les biofilms. Les prédateurs naturels de ces microorganismes que sont les protozoaires libres de l’environnement (amibes notamment) favorisent également ces échanges génétiques.
Au total, toutes les conditions sont réunies pour qu’émergent dans l’environnement de nouvelles résistances aux antibiotiques, à la fois dans la flore bactérienne environnementale, mais également dans la flore humaine et animale capable de survivre dans cet environnement.
6. L’environnement comme source de nouvelles antibiorésistances chez l’homme et les animaux
L’homme et les animaux sont fréquemment colonisés par les microorganismes provenant de leur environnement hydro-tellurique. Cette colonisation est soit directe au contact de cet environnement lors des activités quotidiennes, soit indirecte (eau de boisson, aliments, objets souillés, arthropodes, etc.) [13]. La flore microbienne commensale de l’homme et des animaux exerce un rôle de barrière microbienne qui protège d’une infection par des espèces exogènes moins bien adaptées. Néanmoins, de nombreuses espèces bactériennes humaines et animales surviennent dans l’environnement et peuvent donc contaminer de nouveau ces hôtes. D’autre part, les microorganismes de réservoir environnemental peuvent coloniser la peau et les muqueuses de l’homme et des animaux. Cette colonisation peut être transitoire et de courte durée (quelques heures ou jours) ou prolongée (quelques semaines à plusieurs mois voire années). Pendant cette période de colonisation, des échanges génétiques entre cette flore exogène et la flore commensale endogène peuvent survenir. Ces échanges sont particulièrement importants au niveau du microbiote digestif, du fait de la richesse et de la diversité de ce microbiote, et de la durée souvent prolongée du portage intestinal des microorganismes environnementaux après leur ingestion.
A noter que les bactéries résistantes aux antibiotiques sont également souvent résistantes aux antiseptiques. Ceux-ci incluent les métaux lourds (argent, cuivre, mercure, etc.) et les biocides (éthanol, formaldéhyde, chlorhexidine, triclosan, ammonium quaternaires, etc.). La pollution de l’environnement par les antiseptiques peut participer à la sélection des microorganismes porteurs de résistances aux antibiotiques. Deux phénomènes permettent de comprendre qu’un antiseptique sélectionne des souches porteuses d’antibiorésistance (ou qu’un antibiotique sélectionne pour la résistance à un antiseptique) :
- les mécanismes génétiques de résistance à un antibiotique et à un antiseptique sont portés par les mêmes supports génétiques (plasmides notamment) ; l’exposition d’une bactérie à l’antibiotique ou à l’antiseptique concernés sélectionne les souches porteuses de résistance aux deux types de composés : c’est la co-résistance ;
- le même mécanisme génétique (codant pour une pompe à efflux par exemple) entraine une résistance à la fois à un antibiotique et un antiseptique ; c’est le phénomène de résistance croisée qui about à la sélection des deux types de résistance en présence de l’une ou l’autre de ces molécules.
7. Synthèse et perspectives : Mieux appréhender les risques liés à l’environnement et à l’élevage intensif
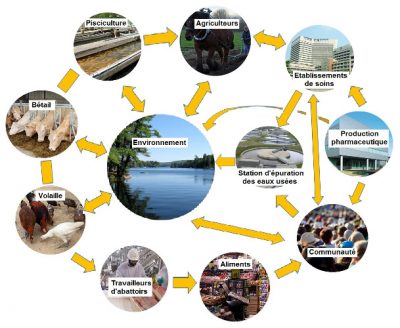
- Les échanges internationaux (humains, animaux, produits alimentaires) nombreux et rapides ont également aggravé cette situation. L’environnement est pollué à la fois par les microorganismes résistants d’origine humaine et animale, et par des concentrations résiduelles d’antibiotiques. Ces deux types de pollutions favorisent l’émergence de nouvelles résistances aux antibiotiques et leurs transferts entre espèces bactériennes.
Du fait des interactions très fortes entre les réservoirs humain, animal et environnemental, la dissémination des mécanismes génétiques d’antibiorésistance est ensuite rapide et majeure. Par rapport aux autres polluants environnementaux (autres médicaments, produits chimiques, métaux lourds, etc.), cette pollution se singularise par sa possible dissémination au sein de la population humaine et animale. En effet, les transmissions inter-humaines, inter-animales, et entre hommes et animaux des bactéries porteuses d’antibiorésistances, expliquent ses effets à la fois individuels et collectifs. Parmi les moyens de lutte contre l’émergence et la diffusion de l’antibiorésistance, il est primordial notamment :
- de réduire et d’optimiser la consommation globale des antibiotiques ;
- d’éviter ou tout au moins de limiter la diffusion des antibiotiques et des bactéries porteuses de gènes de résistance dans l’environnement, en particulier à partir des sources principales (hôpitaux, usines de fabrication des antibiotiques, élevages intensifs, stations d’épuration des eaux, etc.) ;
- d’améliorer le niveau d’hygiène et développer des systèmes d’assainissement des eaux dans les pays en voie de développement ;
- de mieux surveiller la pollution environnementale par les antibiotiques et les gènes d’antibiorésistance [14], [15].
8. Messages à retenir
- La consommation mondiale des antibiotiques se chiffre en milliards de doses quotidiennes et ne cesse d ‘augmenter.
- Les antibiotiques consommés par l’homme et les animaux modifient profondément leur flore microbienne commensale et sélectionne des souches bactériennes de plus en plus résistantes à ces molécules.
- Les capacités d’adaptation des bactéries pathogènes de l’homme et des animaux liées à leur plasticité génomique leur permettent de développer et d’échanger sans cesse de nouveaux mécanismes d’antibiorésistance.
- Les antibiotiques consommés par l’homme et les animaux, ainsi que les bactéries porteuses de mécanismes d’antibiorésistance, sont dispersés dans l’environnement sous forme active.
- L’environnement est un réservoir naturel de nombreuses espèces bactériennes et de gènes d’antibiorésistance, enrichi en permanence par les pollutions de source humaine et animale.
- Les échanges permanents entre les réservoirs humain, animal et environnemental pérennisent l’émergence et la diffusion de l’antibiorésistance
- Il est nécessaire de développer de nouveaux antibiotiques et de nouvelles stratégies thérapeutiques pour lutter contre l’antibiorésistance, mais également de diminuer et d’optimiser la consommation des antibiotiques actuels chez l’homme et l’animal
Références et notes
Image de couverture. Isolement d’une colonie bactérienne sur milieu sélectif, avant test de sensibilité aux antibiotiques. [Source : Getty Images, libre de droits.]
[1] Un élément génétique mobile est un segment du génome dont la position n’est pas fixe. Ces éléments ont été découverts par la cytogénéticienne américaine Barbara McClintock, qui a obtenu pour cela le prix Nobel de physiologie ou de médecine en 1983. Il en existe une grande variété, notamment les plasmides, les transposons, les intégrons).
[2] Processus dans lequel un organisme intègre du matériel génétique provenant d’un autre organisme sans en être le descendant (aussi appelé transfert latéral de gènes). Une grande partie du génie génétique consiste à effectuer un transfert horizontal artificiel de gènes.
[3] Pendleton JN, Gorman SP, Gilmore BF. (2013). Clinical relevance of the ESKAPE pathogens. Expert Rev Anti Infect Ther. 11(3):297‑308.
[4] Finley RL, Collignon P, Larsson DGJ, McEwen SA, Li X-Z, Gaze WH, et al. (2013). The scourge of antibiotic resistance: the important role of the environment. Clin Infect Dis, 57(5):704‑10.
[5] D’Costa VM, King CE, Kalan L, Morar M, Sung WWL, Schwarz C, et al. (2011). Antibiotic resistance is ancient. Nature. 477(7365):457‑61.
[6] Cantón R. (2009). Antibiotic resistance genes from the environment: a perspective through newly identified antibiotic resistance mechanisms in the clinical setting. Clin Microbiol Infect. 15 Suppl 1:20‑5.
[7] Larsson DGJ. (2014). Antibiotics in the environment. Ups J Med Sci. 119(2):108‑12
[8] Singer AC, Shaw H, Rhodes V, Hart A. (2016). Review of Antimicrobial Resistance in the Environment and Its Relevance to Environmental Regulators. Front Microbiol. 7:1728.
[9] Lekshmi M, Ammini P, Kumar S, Varela MF. (2017). The Food Production Environment and the Development of Antimicrobial Resistance in Human Pathogens of Animal Origin. Microorganisms. 5(1).
[10] Hosein IK, Hill DW, Jenkins LE, Magee JT. (2002). Clinical significance of the emergence of bacterial resistance in the hospital environment. J Appl Microbiol, 92 Suppl:90S‑7S.
[11] Le-Minh N, Khan SJ, Drewes JE, Stuetz RM. (2010). Fate of antibiotics during municipal water recycling treatment processes. Water Res. 44(15):4295‑323.
[12] Nesme J, Cécillon S, Delmont TO, Monier J-M, Vogel TM, Simonet P. (2014). Large-scale metagenomic-based study of antibiotic resistance in the environment. Curr Biol, 24(10):1096‑100.
[13] Zurek L, Ghosh A. (2014). Insects represent a link between food animal farms and the urban environment for antibiotic resistance traits. Appl Environ Microbiol. 80(12):3562‑7.
[14] Pruden A, Larsson DGJ, Amézquita A, Collignon P, Brandt KK, Graham DW, et al. (2013). Management options for reducing the release of antibiotics and antibiotic resistance genes to the environment. Environ Health Perspect. 121(8):878‑85.
[15] Laxminarayan R, Duse A, Wattal C, Zaidi AKM, Wertheim HFL, Sumpradit N, et al. (2013). Antibiotic resistance-the need for global solutions. Lancet Infect Dis. 13(12):1057‑98.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : MAURIN Max (29 octobre 2018), Antibiotiques, antibiorésistance et environnement, Encyclopédie de l’Environnement. Consulté le 20 janvier 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/antibiotique-antibioresistance-environnement/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







