Biofilms bactériens et santé
PDF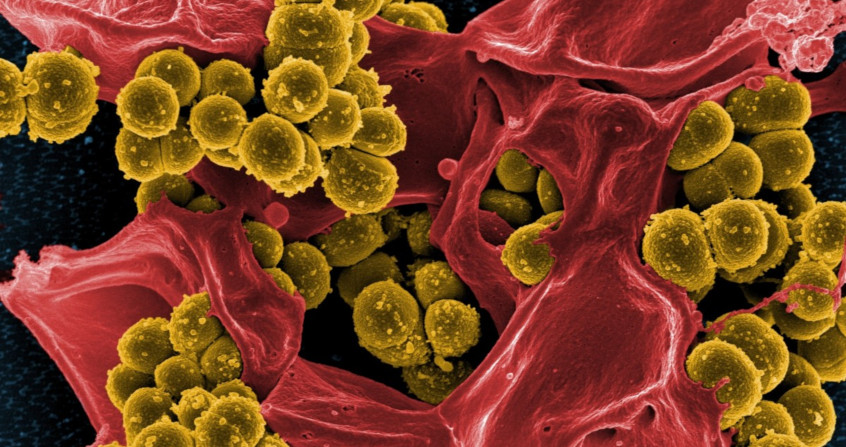
Qu’est-ce qu’un biofilm ? C’est un mode de vie en communautés qui permet à des microorganismes – des êtres unicellulaires tels que les bactéries – d’adopter un comportement de groupe. Les biofilms sont le plus souvent fixés à un support et ils sont ubiquitaires. Ce fut d’ailleurs un des premiers modes d’organisation du vivant au fond des océans, il y a quelques milliards d’années. La majorité des infections bactériennes impliquent des biofilms, ce qui favorise la survenue des formes chroniques et entraine des difficultés de traitement. Aucune stratégie efficace n’a encore pu être mise au point, mais une meilleure connaissance des mécanismes impliqués dans la formation et le maintien de ces agrégats devrait permettre d’élaborer prochainement des approches innovantes et efficaces.
1. Biofilms ou comment des êtres unicellulaires s’organisent en communautés

Mais ce n’est que beaucoup plus tard que le terme de « film bactérien » puis de « biofilm » fut popularisé, notamment par J. William Costerton [2] dans les années 1980. Costerton était un microbiologiste canadien (1934 – 2012), intéressé notamment par les bactéries du milieu aquatique. Il a montré que, contrairement aux données établies, le mode de vie dominant des bactéries était sous forme de communautés complexes apparentées à un être pluricellulaire qu’il a dénommées biofilms.
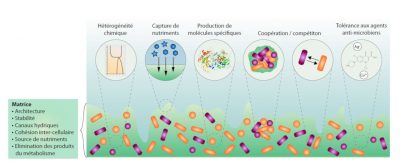
Les biofilms sont définis comme des agrégats organisés de microorganismes pouvant contenir jusqu’à 100 millions (108) à 10 milliards (1010) cellules par gramme de matière déshydratée. Au sein de ces structures, les cellules bactériennes sont entourées d’une gangue appelée matrice, produite par les bactéries elles-mêmes et qui joue un rôle majeur en assurant la cohésion de l’ensemble, voire la fixation à la surface du substrat.
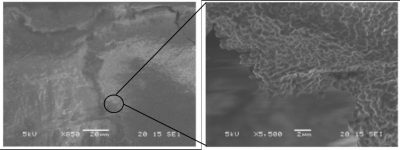
La majorité des bactéries sont capables de former des biofilms et les différentes étapes conduisant à la formation d’agrégats complexes et hétérogènes à partir de quelques bactéries individuelles ont été largement décrites pour certaines espèces (Figure 2). Il s’agit de phénomènes parfaitement coordonnés et génétiquement programmés.
1.1. Les étapes de formation des biofilms
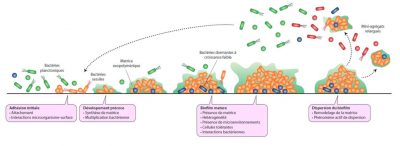
L’étape suivante dite de maturation permet le développement d’une structure tridimensionnelle avec mise en place d’un environnement hétérogène dans lequel les bactéries évoluent et interagissent, sous la forme de compétition ou de synergie.
Enfin, l’étape ultime consiste en une phase de dispersion, avec détachement d’un certain nombre de bactéries du biofilm isolées ou sous forme de microagrégats, susceptibles de coloniser d’autres surfaces.
1.2. Les propriétés spécifiques des biofilms
1.3. Les biofilms : des réservoirs de bactéries en dormance
Les communautés organisées que sont les biofilms constituent des réservoirs de bactéries, capables de survivre aux agressions extérieures (agents anti-infectieux, déshydratation,..) et de maintenir ainsi des formes viables malgré des conditions extérieures hostiles. Ceci est rendu possible par la tranformation de certaines cellules du biofilm en formes dormantes, avec des fonctions vitales ralenties, ce qui leur permet d’échapper à l’action de la plupart des agents anti-infectieux qui nécessitent pour être actifs des bactéries capables de se répliquer. Mais si cette forme de vie permet aux bactéries de franchir des étapes difficiles, elle n’est pas pour autant figée, et des bactéries sous forme individuelle ou de mini-agrégats sont capables de s’échapper de biofilms constitués.
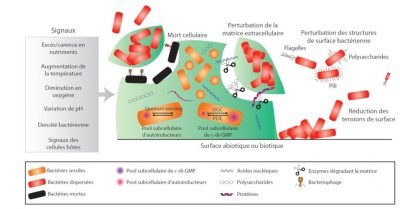
2. Les processus d’infection revisités à l’aune des biofilms
Les principales bactéries incriminées proviennent des microbiotes propres aux patients (exemples : microbiotes de la plaque dentaire et endocardites, microbiote intestinal et infections urinaires) ou de son environnement et mis à part les infections profondes, les biofilms incriminés sont généralement constitués de plusieurs espèces bactériennes (Lire Les microbiotes humains : des alliés pour notre santé).
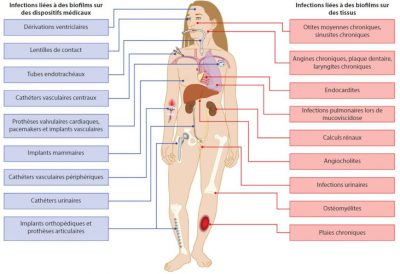
La présence simultanée de différentes espèces bactériennes peut également jouer un rôle actif dans les processus de détachement à partir d’un biofilm constitué et donc influencer la dissémination parfois sélective de bactéries dans l’organisme. Dans un modèle murin, la colonisation des muqueuses nasales par le couple de bactéries pathogènes S. aureus – Streptococcus pneumoniae entraîne la survenue d’infections pulmonaires essentiellement dues à S. pneumoniae, S. aureus étant en quelque sorte piégé dans le biofilm mixte.
Ces données récentes devraient contribuer à modifier considérablement les approches diagnostiques en clinique. La prise en compte d’un écosystème et des interactions entre microorganismes au niveau des sites de portage ou infectieux s’avère indispensable. Ainsi l’analyse globale des microorganismes présents et non pas la recherche spécifique d’un pathogène donné pourrait s’avérer particulièrement pertinente, notamment dans une approche préventive pour déterminer les situations à haut risque de développement de pathologies infectieuses.
3. Stratégies thérapeutiques anti-biofilm ou comment lutter contre les biofilms ?
Le traitement des infections liées à la formation de biofilm est particulièrement délicat, et ceci pour de multiples raisons. Outre la présence simultanée de plusieurs espèces bactériennes, la forme de vie biofilm complexifie les traitements car les bactéries ainsi agrégées présentent des mécanismes de résistance aux agents anti-infectieux qui se surajoutent à leurs mécanismes de résistance propre (génétique et individuelle). [6] Plusieurs éléments sont responsables de cette « indifférence » aux antibiotiques des bactéries sous forme biofilm : défaut de pénétration pour certaines molécules, inefficacité due à la réduction du niveau d’oxygène dans les couches profondes des agrégats bactériens, ou acidité locale pour d’autres. Mais le mécanisme le plus sophistiqué est sans aucun doute la forme de vie particulière qu’adoptent certaines bactéries au sein des biofilms et qui s’apparente à un état de dormance, avec un ralentissement global de leur métabolisme. Les antibiotiques sont alors inactifs car leurs cibles cellulaires ne sont pas synthétisées par les bactéries (Voir Figure 2).
Selon les situations, l’objectif pour lutter contre les biofilms consiste à inhiber leur formation (stratégies préventives) ou à désintégrer un biofilm existant (stratégie curative) sans entrainer la dissémination dans l’organisme de bactéries vivantes capables de coloniser d’autres sites (Figure 7).
3.1. Stratégies préventives anti-biofilm
Plusieurs stratégies préventives anti-biofilm ont été développées, destinées à contrecarrer différentes étapes de formation du biofilm. Empêcher l’adhésion initiale des bactéries aux surfaces a été largement exploité, soit en modifiant la structure physico-chimique des matériaux, en leur incorporant des agents anti-bactériens ou en recouvrant les surfaces de molécules anti-adhésion (biosurfactants). La nature de ces molécules est assez diverse mais de nombreux exemples d’origine bactérienne ont été décrits, notamment des exo-polysaccharides, ce qui laisse à penser que cette stratégie est naturellement employée par les bactéries lors de la constitution de biofilms dans un environnement compétitif.
Quelles que soient les modifications de surface apportées, ces approches s’avèrent assez décevantes, car les matériaux sont rapidement conditionnés par des molécules organiques (tel que le collagène en ce qui concerne les dispositifs médicaux) qui neutralisent l’effet anti-adhésion, voire favorise cette étape.
Prévenir la formation de biofilm dans des cathéters utilisés à long terme (cathéter de dialyse) est couramment réalisé en introduisant des solutions anti-bactériennes (antibiotiques, éthanol) dites « solutions verrou » dans la lumière des dispositifs en dehors des périodes d’utilisation. Si cette pratique s’avère efficace – empêcher le développement des bactéries limite bien évidemment la formation d’agrégats – l’emploi d’antibiotiques à fortes concentrations entraine inévitablement un risque écologique en terme de développement de résistances, et de plus, l’impact de ces solutions sur l’intégrité des matériaux reste souvent méconnu.
3.2. Stratégies curatives anti-biofilm
Quant au traitement de biofilms déjà formés, il s’avère particulièrement délicat. L’utilisation d’antibiotiques requiert non seulement des doses largement supérieures aux concentrations classiquement administrées chez l’Homme mais certaines molécules peuvent paradoxalement exercer un effet stimulant sur la formation de biofilm. Un traitement idéal devrait être capable de déstabiliser le biofilm, stimuler les formes dormantes et exercer un effet lytique sur l’ensemble des microorganismes. Des approches enzymatiques visant à déstructurer la matrice du biofilm ont été décrites (glycosidases, nucléases) mais les effets bénéfiques déterminés sur des biofilms constitués d’une espèce bactérienne sont souvent difficilement extrapolables à des biofilms complexes.[7]
Une autre approche consiste à interférer avec les mécanismes de régulation en neutralisant les molécules responsables de la transmission entre bactéries des signaux impliqués dans la structuration des biofilms. Malgré la complexité de ces réseaux de signalisation, de nombreuses pistes ont été étudiées dans des modèles expérimentaux et ont donné lieu à des résultats prometteurs. Les applications pratiques semblent cependant assez éloignées ; la séquestration de ces molécules dans la matrice extracellulaire, une répartition hétérogène au sein des biofilms constituent les principaux écueils de cette approche innovante. Dans tous les cas, cette stratégie devrait être couplée à un traitement bactéricide de façon à lyser les bactéries ainsi libérées afin d’éviter qu’elles ne colonisent d’autres sites, et ceci ne peut être obtenu que si ces cellules bactériennes sont métaboliquement actives. Il est donc essentiel, dans le cadre de la lutte contre les biofilms, non seulement de désorganiser les agrégats formés mais également de réanimer les cellules en dormance. Plusieurs approches peuvent être utilisées, les plus efficaces consistant à favoriser leur croissance en apportant des nutriments ou à endommager leurs membranes et induire ainsi un processus lytique. Certains peptides anti-microbiens sont capables d’agir au niveau des membranes de cellules en dormance, avec plus ou moins de spécificité quant aux espèces bactériennes ciblées, et pourraient constituer à terme des éléments importants de l’arsenal thérapeutique anti-biofilm.
En conclusion, les capacités de la plupart des bactéries à s’organiser en biofilms constituent un problème supplémentaire lors de la mise en place de traitements anti-infectieux. Aucune stratégie efficace n’a encore pu être mise au point, mais une meilleure connaissance des mécanismes impliqués dans la formation et le maintien de ces agrégats devrait permettre d’élaborer prochainement des approches innovantes et efficaces.
4. Messages à retenir
- Nos principales connaissances du monde bactérien découlent de l’étude des bactéries sous la forme de cellules individualisées cultivées en laboratoire dans des milieux adaptés.
- Dans la nature, les bactéries vivent majoritairement sous la forme de communautés agrégées appelées biofilms. Ce mode de vie leur permet d’opter pour un comportement coordonné de groupe et leur confère un certain nombre d’avantages, concernant notamment leurs capacités à résister aux agressions extérieures.
- Cette découverte a modifié profondément l’approche du monde bactérien au cours des dernières décennies et invite à considérer d’un œil nouveau l’ensemble des données, que ce soit à propos des bactéries pathogènes ou de celles qui constituent nos microbiotes.
Notes et références
Image de couverture. Image libre de droit.
[1] Antoni van Leeuwenhoek (1632 – 1723) est un marchand et un savant néerlandais. Il est surtout connu pour ses travaux sur le microscope (on pense qu’il a été inventé par Hans et Zacchary Jensen, ou encore par Galilée) dont il a construit de nombreux exemplaires. Il se servait de cet instrument pour compter le nombre de fils d’un tissu, et leur épaisseur. Il eut surtout l’idée d’observer le milieu environnant, et fut l’un des premiers scientifiques à avoir utilisé le microscope pour explorer le monde des micro-organismes.
[2] J. William Costerton (1934 – 2012) est un microbiologiste canadien. Pionnier de la reconnaissance des biofilms bactériens comme mode de croissance dominant des bactéries, Costerton a démontré leur importance dans la résistance des bactéries aux agents antibactériens et la persistance de certaines infections bactériennes chroniques.
[3] McCoy W.F., Bryers J.D., Robbins J. & Costerton J.W. (1981) Observations of fouling biofilm formation. Can J Microbiol. 27(9):910-917; Zobell C.E. & Allen E.C. (1935) The significance of marine bacteria in the fouling of submerged surfaces. J Bacteriol. 29(3):239-251.
[4] Lebeaux D, Ghigo JM & Beloin C (2014) Biofilm-related infections: bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics. Microbiol Mol Biol Rev. Sep;78(3):510-543. doi: 10.1128/MMBR.00013-14
[5] Alves P.M., l-Badi E., Withycombe C., Jones P.M., Purd K.J. & Maddocks S.E. (2018) Interaction between Staphylococcus aureus and Pseudomonas aeruginosa is beneficial for colonisation and pathogenicity in a mixed biofilm. Pathogens Dis. 76, fty003 ; Reddinger R.M., Luke-Marshall N.R., Sauberan S.L., Hakansson P. & Campagnari A. (2018) Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio, 9 e02089-17
[6] Davies D. (2003). Understanding biofilm resistance to anti- bacterial agents. Nat Rev Drug Discov 2:114–122 ; Lewis K. (2001) Riddle of biofilm resistance. Antimicrob Agents Chemother 45:999e1007.
[7] Ko H., Allan R.N., Howlin R.P., Stoodley P. & Hall-Stoodley L. (2017) Targeting microbial biofilms: current and prospective therapeutic strategies. Nature Microbiol Rev. 15:740-754 ; Miquel S., Lagrafeuille R., Souweine B. & Forestier C. (2016) Anti-biofilm activity as a health issue. Front Microbiol. 7:592.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : AUMERAN Claire, BALESTRINO Damien, FORESTIER Christiane (17 mars 2020), Biofilms bactériens et santé, Encyclopédie de l’Environnement. Consulté le 1 avril 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/biofilms-bacteriens/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







