Les microbiotes humains : des alliés pour notre santé
PDF
L’organisme humain héberge toute une communauté de microorganismes : bactéries, archées, levures et virus. Aujourd’hui regroupés sous le terme de « microbiote », ils participent à de nombreuses fonctions biologiques. Nous avons ainsi développé un véritable mutualisme avec eux. Nous hébergeons des microorganismes au niveau de la peau (microbiote cutané), dans la bouche (microbiote bucco-dentaire), dans les organes génitaux (microbiote vaginal) et dans l’intestin (microbiote intestinal). Nous concevons aisément d’avoir des bactéries dans des zones de contact avec l’extérieur (peau, bouche). Mais le fait que notre tube digestif héberge aussi un nombre impressionnant de bactéries est nettement moins intuitif, surtout quand il s’agit de zones très profondes comme le côlon où l’on en trouve plus de 1011 par gramme de contenu intestinal. Au total, notre microbiote intestinal contient 100 000 milliards de micro-organismes contribuant très largement au bon fonctionnement de notre organisme et à notre santé. Les Hommes représentent donc un écosystème complexe composé de cellules humaines et de micro-organismes. Et si les microbiotes étaient finalement des organes négligés ?
- 1. L’Homme et ses microbiotes
- 2. Focus sur l’écosystème intestinal
- 2.1. La naissance d’un écosystème
- 2.2. Les populations bactériennes du microbiote : un état d’équilibre
- 2.3. Les cellules humaines et les bactéries participent à la digestion
- 2.4. Un écosystème microbiote/intestin : une barrière indispensable face à des intrus
- 2.5. Des bactéries qui éduquent notre système immunitaire
- 2.6. Le couple microbiote/cellules intestinales : un dialogue qui s’entend dans tout l’organisme
- 3. Les perturbations de l’écosystème intestinal : causes du développement de pathologies
- 4. Le microbiote, une cible thérapeutique d’avenir
1. L’Homme et ses microbiotes
L’Homme n’héberge pas un mais plusieurs microbiotes. En effet, on ne trouve pas les mêmes micro-organismes dans toutes les zones du corps et leur prolifération dépend totalement de leur lieu d’hébergement. Source de nutriments, conditions d’humidité, présence ou absence d’oxygène, plusieurs facteurs influencent la nature des microorganismes capables de proliférer dans telle ou telle zone. On trouve donc entre autres un microbiote cutané, un microbiote des voies oro-pharyngéesLes voies oro-pharyngées englobent les voies aériennes et digestives supérieures, c’est à dire les cavités buccales et nasales., un microbiote vaginal et un microbiote intestinal. La niche occupée par chaque microbiote peut-être très restreinte, comme des zones de peau spécifique, aisselles ou peau du dos.
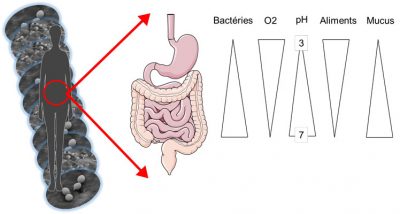
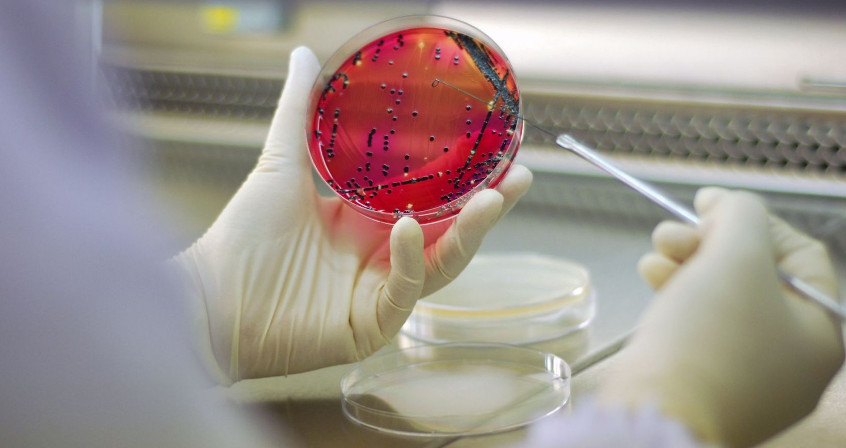
Le microbiote cutané se nourrit de sébumSubstance produite par de petites glandes présentes au niveau de la peau. Le sébum est constitué de lipides. Il agit comme une couche protectrice sur notre peau. et de kératinocytesCellules majoritairement présentes sur notre peau. morts. Il évolue à la fois dans des zones humides, comme les aisselles ou les plis cutanés, et dans des zones plus sèches mais également plus grasses comme la peau du dos. De la même manière, notre microbiote intestinal varie en fonction de sa localisation le long du tube digestif (haut ou bas). En effet, l’estomac est acide et riche en l’oxygène tandis que le côlon, la partie terminale de notre intestin, est totalement privée d’oxygène et sans acidité.
La quantité de micro-organismes, et en particulier de bactéries, varie aussi en fonction de la zone occupée : de l’ordre de 1000 bactéries dans l’estomac à 1011 dans le côlon, jusqu’à 1 million de bactéries par cm2 de peau ! Au total, l’ensemble de notre tube digestif regroupe 100 000 milliards de bactéries, et notre microbiote intestinal pèse à lui-seul près de 1,5 kg chez un adulte (Figure 1).
1.1. Les bactéries, microorganismes majeurs de nos microbiotes
Un microbiote désigne une communauté complexe de micro-organismes qui peut être constituée de levures, d’archées, de champignons, de virus et de bactéries. Les bactéries sont les plus abondantes, c’est pourquoi un raccourci entre microbiote et bactéries est souvent fait. A ce jour, ce sont donc ces bactéries les mieux connues et décrites (surtout dans les parties distales du tube digestif, c’est à dire le côlon). Par exemple, les levures du tractus digestif représentent moins de 0,5% du microbiote intestinal, tandis que les bactéries en représentent plus de 90%. Tous ces micro-organismes vivent en communauté mais dialoguent aussi avec nos cellules : il existe un équilibre constant et dynamique entre ces populations dont l’abondance relative peut évoluer constamment. Certaines communautés vont être altérées après un bain de bouche ou une prise d’antibiotiques, d’autres en profitant alors pour occuper l’espace et se faire une niche. La dynamique des populations formant les microbiotes résulte des interactions avec l’environnement. Les microbiotes peuvent être décrits par les micro-organismes qui les composent : on établit alors une « cartographie », à un moment donné, des espèces présentes et de leur quantité.
Nous pouvons avoir accès à une grande majorité de notre microbiote intestinal via nos selles (prélèvements fécaux) ; bien qu’ils soient faciles à obtenir, le microbiote intestinal a longtemps gardé ses secrets. La raison en est simple : les micro-organismes, et notamment les bactéries si nombreuses dans l’intestin, sont très difficiles à cultiver car très sensibles à la présence d’oxygène qui en tue plus de 60%. Voilà pourquoi elles aiment se confiner dans la partie basse du tube digestif (côlon) : dans cette zone, pas d’oxygène ! Ces bactéries ont aussi des préférences alimentaires et des besoins en nutriments qui restent encore mal connus. A défaut de pouvoir en obtenir en grande quantité par culture au laboratoire, les scientifiques décryptent leur ADN. De grands projets de séquençage de l’ADN à haut débit de nos microbiotes ont ainsi été lancés entre 1995 et 2005 [1]. Ils ont permis d’établir des cartographies fines des microbiotes hébergés sur et dans notre corps et des gènes qu’ils portent (Figure 2). Différentes méthodes de biologie moléculaire et de séquençage ont été utilisées pour dresser des « métagénomes » qui représentent toutes les séquences de tous les génomes des bactéries dominantes et sous dominantes d’un écosystème. Ainsi, le métagénome intestinal a permis d’établir un catalogue de gènes bactériens représentatifs d’individus en fonction de leur état de santé, de leur génétique, de leur alimentation et de leurs conditions de vie.
Outre l’approche du métagénome, le séquençage peut être plus partiel en ciblant le gène codant la petite sous-unité du ribosome (16S) permettant de décrire les espèces bactériennes présentes au sein du microbiote. Cela permet de caractériser les espèces et d’évaluer leurs quantités relatives.
1.2. Les années 2000 : à la conquête des microbiotes humains
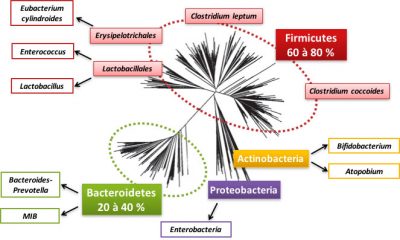
Détaillons donc ce monde bactérien qui nous habite. Le microbiote intestinal regroupe 800 à 1000 espèces de bactéries qui appartiennent majoritairement à deux groupes bactériens (ou phyla) : les Firmicutes et les Bacteroidetes (voir Figure 2). Les Proteobacteria, les Actinobacteria, les Verrucomicrobia et les Fusobacteria sont également présents mais minoritaires (Figure 2). Au sein de ces phyla, on retrouve des familles bactériennes, comme la famille des Lactobacillales du phylum des Firmicutes. Dans ces familles, on différencie des espèces bactériennes, telle que Clostridium coccoides. Une grande fraction des espèces est spécifique de chaque individu. Les archées [2] sont souvent présentes dans le microbiote intestinal, en particulier les archées qui participent à la production de méthane.
On considère que le microbiote d’un individu est aussi unique que ses empreintes digitales ! Cependant, certaines espèces sont considérées comme “fondatrices” comme Faecalibacterium prausnitzii ou Akkermansia muciniphila : elles sont en effet présentes chez la majorité des individus et leur absence semble associée à des pathologies.
L’ADN d’une cellule humaine contient près de 3 milliards de bases organisées en 25000 gènes. Mais les bactéries ne possèdent qu’environ un million de bases constituant 2000 à 3000 gènes. Si l’on compare une cellule humaine à une bactérie, le potentiel génétique bactérien est donc 10 fois plus faible. Cependant, si l’on considère les 500 à 1000 espèces composant notre microbiote intestinal, les bactéries peuvent exprimer 100 à 150 fois plus de gènes que l’hôte qui les héberge.
Lancés entre 1995 et 2005 (voir [1]), les grands projets de séquençage de l’ADN de nos microbiotes ont permis d’établir des cartographies fines de leurs gènes. Des catalogues ont ainsi été établis, regroupant 3 à 10 millions de gènes retrouvés au sein des différentes espèces bactériennes des microbiotes intestinaux humains. Ces gènes permettent aux bactéries d’assurer des fonctions bien précises (digérer des nutriments, produire des vitamines…) et nécessaires au bon fonctionnement de l’être humain. Ainsi, plus le patrimoine génétique porté par les micro-organismes est varié, plus le potentiel métabolique du microbiote est vaste. Entre différents individus, il y a une diversité des espèces qui composent le microbiote intestinal mais les fonctions assurées par les bactéries peuvent être communes ou redondantes.
Ces catalogues de gènes bactériens du microbiote permettent de comparer des individus, ou des groupes d’individus, en fonction de leur âge, leur condition de vie et leur état de santé. La diversité des gènes du microbiome intestinal pourrait même être un marqueur de susceptibilité à certaines pathologies : plus vous portez de gènes bactériens différents dans l’intestin plus ce capital génique semble bénéfique pour la santé.
1.3. Les microbiotes « buccal », « vaginal » et « pulmonaire » humains
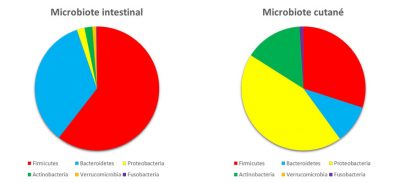
Les surfaces de notre corps sont colonisées par des bactéries appartenant aux mêmes phyla que celles de notre tube digestif. En revanche, l’abondance des phyla va être différente. Principale explication ? Les nutriments apportés par la peau et les conditions locales (oxygène, acidité…) favorisent la croissance de certaines bactéries plutôt que d’autres (Figure 3).
Le microbiote de la peau est principalement constitué de Firmicutes, de Protéobactéries et d’Actinobactéries… dont une fameuse propionibactérie : Propionibacterium acnes, la bactérie des boutons d’acné ! La cavité vaginale renferme surtout des Firmicutes avec une forte prédominance de Lactobacilles (jusqu’à 70% chez la femme). En effet, ces bactéries résistent à l’acidité du vagin (pH de 4,5 chez la femme) : elles contribuent même à maintenir et sont également résistantes à l’oxygène. Si la niche écologique vaginale est donc favorable à la prédominance de Lactobacilles, ces derniers représentent en revanche moins de 1% du microbiote intestinal.
Le microbiote pulmonaire a été décrit en 2010. Certes, on savait depuis longtemps que des pathogènes peuvent se créer une niche dans les poumons et y induire une affection respiratoire. Mais il a fallu attendre les méthodes de séquençage actuelles pour mieux connaître les bactéries naturellement présentes dans le poumon d’un individu sain. Ce microbiote pulmonaire compte environ 10 000 bactéries par gramme de poumon ou de fluide présent dans les bronches et les alvéoles pulmonaires. Il est principalement constitué de Protéobactéries, de Firmicutes et de Bactéroides. Un nouveau pan de recherche s’ouvre pour mieux comprendre la contribution des bactéries sur l’immunité pulmonaire et la susceptibilité des individus à certaines maladies respiratoires.
Véritables écosystèmes bactériens, nos différents microbiotes, sont donc très dépendants des territoires qu’ils colonisent et sensibles à toutes les interventions extérieures. Voilà pourquoi la composition des microbiotes du corps humain n’est pas figée dans le temps ; les écosystèmes qu’ils constituent sont dynamiques et évoluent en fonction des pressions de sélection. Par exemple, les menstrues perturbent les équilibres entre différents lactobacilles du vagin. L’usage intensif de savon peut quant à lui déclencher une hécatombe des espèces bactériennes, favorisant ainsi la prolifération des levures et provoquer l’apparition d’une infection à levures du genre Candida. L’alimentation et d’une façon plus large tous les produits que nous consommons tels que les médicaments (antibiotiques, anti-acides…) modifient les bactéries de la cavité buccale et de l’intestin.
2. Focus sur l’écosystème intestinal
Les activités biologiques préservant l’homéostasieEnsemble de régulations biologiques qui vont permettre de maintenir un équilibre, par exemple la régulation de notre température corporelle. et la physiologie résultent des activités des cellules humaines, des microbiotes et de leurs interactions constantes et mutuelles. Par exemple, les fonctions du tube digestif (digestion, protection contre des pathogènes) sont assurées par nos cellules mais aussi par les bactéries. Le microbiote intestinal assure ainsi un grand nombre de fonctions biologiques qui participent à notre santé. Il coopère avec nos propres cellules pour assurer la digestion de nombreux aliments, la protection face aux infections et la maturation de notre système immunitaire acquis et inné. Le microbiote intestinal peut aussi contribuer à des fonctions extra-intestinales en produisant des molécules qui vont induire une réaction biologique et qui peuvent agir à distance, y compris sur le cerveau.
2.1. La naissance d’un écosystème
Les bactéries et nos cellules intestinales, formant le tractus digestif, s’échangent des signaux, se tolèrent et parfois entrent en compétition pour des nutriments. Le tractus digestif doit donc être considéré comme un écosystème ; ses fonctions et sa structure dépendent des interactions entre bactéries et cellules du milieu environnant et des flux de matière et d’énergie.
L’équilibre dynamique entre les populations bactériennes et cellulaires de l’intestin se co-construit à la naissance. Cette construction de l’écosystème intestinal est progressive et séquentielle. A la naissance, notre corps peut être considéré comme exempt de micro-organismes : la colonisation débute dès que commencent les contacts avec l’environnement. Les bactéries de la famille des Lactobacilles (Enterococcus) et des Entérobactéries (E. coli) ainsi que des Bifidobactéries colonisent le tube digestif dès la naissance. Nommées « primo-colonisatrices », les premières bactéries font diminuer le taux d’oxygène, ce qui va ensuite favoriser l’arrivée de bactéries trop sensibles à l’oxygène comme les Clostridium leptum. Ces bactéries primo-colonisatrices sont abondantes et dominantes en période périnatale, puis deviennent sous-dominantes dès 2-3 ans. Ce processus de primo-colonisation dépend de nombreux paramètres, dont les conditions de naissance et le mode d’alimentation du bébé. Par exemple, les bactéries du lait maternel participent à la diversification du microbiote intestinal de l’enfant. On a aussi découvert que les microbiotes intestinaux diffèrent entre les enfants nés par césarienne ou par voie basse. Dans le premier cas, le microbiote des enfants a une composition proche des populations bactériennes de l’environnement (mains du personnel médical, peau). Tandis que les enfants nés par voie basse ont un microbiote intestinal plus proche de celui du vagin de la mère. Les bactéries primo-colonisatrices jouent un rôle prépondérant pour le nouveau-né puisqu’elles établissent le premier dialogue avec l’hôte. L’acquisition du microbiote à la naissance peut donc ensuite perturber l’implantation d’autres bactéries.
Durant les trois premières années de vie, le microbiote intestinal se façonne à la suite de la primo-colonisation, puis au gré de l’alimentation et des bactéries rencontrées dans les aliments, l’entourage et l’environnement. Cependant, notre mode de vie actuel réduirait trop l’exposition aux bactéries. En cause : une trop large utilisation d’antibiotiques, et des environnements de vie trop aseptisés. Cela pourrait retarder ou compromettre la mise en place de la symbiose entre l’hôte et son microbiote. L’altération de cette symbiose pourrait à son tour entrainer des défauts de maturation du système immunitaire. En bout de chaine : un risque accru de maladies telles que les allergies, y compris l’asthme allergique ou les maladies inflammatoires.
2.2. Les populations bactériennes du microbiote : un état d’équilibre
Nous avons déjà étayé par de nombreux exemples la flexibilité du microbiote intestinal. Les équilibres entre les populations de micro-organismes oscillent toujours en fonction des conditions de vie et de l’alimentation. La dynamique des populations des microbiotes est également façonnée par les micro-organismes entre eux qui peuvent être des « aidants », des compétiteurs ou des pathogènes. Ainsi, les micro-organismes apportés par des aliments fermentés contribuent de façon transitoire à notre microbiote intestinal. Quand vous mangez un yaourt de 100 g, vous ingérez environ un milliard de bactéries appartenant à deux espèces : Lactobacillus bulgaricus et Streptococcus thermophilus. Même si ces micro-organismes apportés par l’alimentation ne se créent pas de niche permanente, leur passage modifie la composition et l’activité de notre microbiote. Par exemple, en produisant du lactate, les bactéries alimentaires lactiques favorisent les bactéries consommant du lactate.
L’équilibre du microbiote peut également connaître des perturbations très fortes. Quand cela va jusqu’à la rupture de l’équilibre existant, on parle de « dysbiose ». Une dysbiose importante apparaît par exemple après une antibiothérapie ou un changement brutal de régime alimentaire. Dans la vie de tous les jours, on sait qu’un changement de régime peut entrainer une diarrhée, manifestation visible d’une forte perturbation du microbiote intestinal. Dans la majorité des cas, les changements de microbiotes sont transitoires et liés à un événement particulier et spécifique. C’est pourquoi le microbiote est considéré comme résilient face à un stress modéré. Cela implique que le microbiote intestinal retrouve une structure proche de celle qu’il avait avant le stress.
Mais il existe aussi des situations où la composition du microbiote va être perturbée durablement. Dans ce cas, le bénéfice mutuel qui s’installe d’ordinaire entre le microbiote et son hôte n’est plus préservé. Tout se passe comme s’ils ne s’adaptaient plus l’un à l’autre. Face à un microbiote modifié, la réponse des cellules intestinales est inadaptée. Parfois, cela conduit à un couple hôte/microbiote explosif source d’altérations dans l’organisme. La dysbiose est un stade auquel le microbiote et l’hôte ne sont donc plus en symbiose. Elle est associée à des états de fragilité ou de pathologie avérée. Par exemple, chez les patients atteints de maladie inflammatoire chronique, la composition du microbiote intestinal est caractérisée par une surabondance d’entérobactéries (E. Coli) et une diminution de bactéries fondatrices comme F. prausnitzii. Chez ces patients, cette dysbiose s’accompagne d’une inflammation de la muqueuse intestinale et d’une altération de la barrière intestinale qui participent à la pathologie.
2.3. Les cellules humaines et les bactéries participent à la digestion
Les aliments sont dégradés par les enzymes de nos cellules : lipases, amylase, saccharases… De quoi nous permettre d’assimiler le gras, de digérer les protéines ou l’amidon. Cependant, nous n’avons pas l’équipement enzymatique pour digérer tous nos aliments.
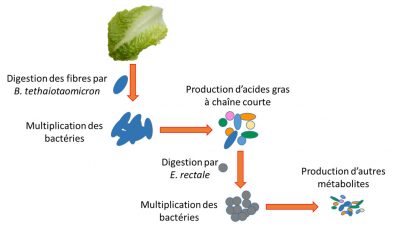
Par exemple, nos cellules ne digèrent pas les fibres végétales qui sont composées d‘oligopolysaccharides. En revanche, certaines bactéries sont armées d’un arsenal enzymatique capable d’assurer la digestion de ces fibres (ex : Bacteroides thetaiotaomicron). Elles transforment ces fibres faites de sucres complexes en nutriments plus simples utilisables par notre organisme. Mais d’autres bactéries sont comme nos cellules incapables de digérer les fibres et dépendent donc des nutriments simples produits par leurs consœurs (ex : Enterococcus rectale). A ce stade, on entrevoit toute la complexité de l’écosystème. Si les fibres ne sont plus digérées parce qu’absentes de l’alimentation ou bien parce que des bactéries comme B. thetaiotaomicron les digérant sont altérées, la survie des bactéries comme E. rectale sera compromise (Figure 4).
Les nutriments, une fois dégradés, sont transportés dans les cellules intestinales par des protéines présentes dans la membrane des cellules nommées » transporteurs ». A partir des cellules intestinales, ces nutriments sont exportés dans le sang par d’autres transporteurs. La présence de ces transporteurs, indispensables au passage des nutriments dans notre organisme, est régie à la fois par les bactéries et les cellules humaines. Par exemple, l’installation des transporteurs de fer dans les cellules intestinales dépend en partie des bactéries intestinales. Toute modification des bactéries peut donc engendrer des perturbations, non seulement de la digestion mais aussi du passage des nutriments dans l’organisme.
Enfin, les bactéries ne font pas que nous aider à digérer. Elles produisent également des substances nutritives dont certaines vitamines comme la vitamine K, indispensable à la coagulation sanguine et sans laquelle nous souffririons d’hémorragies.
2.4. Un écosystème microbiote/intestin : une barrière indispensable face à des intrus
Situé à l’interface entre le monde extérieur et notre milieu intérieur, le tractus digestif joue un rôle de barrière essentiel. Là encore, nos cellules et les microorganismes que nous hébergeons coopèrent pour nous protéger. Les bactéries font écran face aux intrus et façonnent notre système immunitaire, tandis que nos cellules forment un rempart cellulaire et immunitaire sélectif.
Un des rôles majeurs du microbiote intestinal est d’empêcher que des micro-organismes pathogènes trouvent la place de proliférer. La densité bactérienne est donc essentielle au maintien de cette barrière. Une des conditions les plus connues où cet équilibre est rompu est l’antibiothérapie. Les antibiotiques n’éliminent pas simplement les bactéries responsables de l’infection, mais aussi toutes les bactéries intestinales sensibles à l’antibiotique. Le microbiote intestinal sera donc d’autant plus altéré que l’antibiotique sera à large spectre, c’est-à-dire capable de tuer des bactéries de familles très différentes. Cette hécatombe permet à des bactéries pathogènes de proliférer. L’infection due à Clostridium difficile est une des complications possibles des antibiothérapies. Ainsi, plus l’antibiothérapie est longue et à large spectre, plus le risque d’infections à C. difficile augmente.
L’épithélium intestinal est la première couche de cellules qui se trouve à l’interface entre la lumière de l’intestin (où est confiné le microbiote) et le milieu intérieur de l’hôte. En constant renouvellement, cet épithélium est constitué de cellules souches qui prolifèrent et de cellules différenciées qui participent à l’absorption des nutriments ou à la sécrétion de molécules. L’équilibre entre prolifération et différenciation est essentiel pour assurer une bonne protection. Une hyper-prolifération de l’épithélium est un moyen de défense qui peut aider à chasser des pathogènes. Les dysbioses sont observées quand la barrière de l’épithélium semble plus lâche et moins efficace pour filtrer les bactéries ou les fragments bactériens.
L’épithélium intestinal joue également un rôle essentiel de protection via la production de mucus. Tapissant l’épithélium, le mucus s’apparente à un gel visqueux constitué de glycoprotéinesProtéines sur lesquelles des sucres sont ajoutées, ce qui leur donnent des propriétés biologiques spécifiques. Présentes, entre autre, sur les membranes cellulaires ; elles favorisent les interactions entre les cellules. très complexes. Il est produit par des cellules spécialisées de l’épithélium intestinal : les cellules productrices et sécrétrices de mucus. Ce mucus éloigne les bactéries de l’épithélium, ce qui empêche leur interaction directe avec les cellules. La barrière fournie par le mucus peut être modulée par l’alimentation et par les bactéries elles-mêmes. Les bactéries capables de digérer les fibres alimentaires sont aussi friandes des sucres complexes du mucus. Ce dernier est donc aussi une source de nutriments pour certaines bactéries du microbiote. En cas de régime pauvre en sucres complexes, B. thetaiotaomicron va dégrader le mucus ; mais en compensation, elle peut produire des signaux stimulant la production de mucus. Un bel exemple de mutualisme de l’écosystème microbiote/intestin.
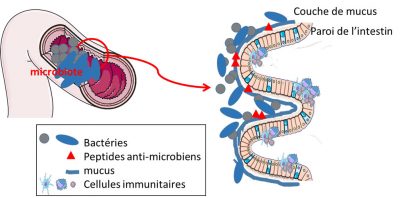
Outre l’éloignement physique imposé par le mucus, il existe aussi une barrière chimique. Certaines cellules intestinales produisent des métabolites ayant des actions anti-microbiennes. Ces composés anti-microbiens vont maintenir les bactéries à distance des cellules intestinales, évitant toute intrusion ou tout contact non contrôlé (Figure 5).
2.5. Des bactéries qui éduquent notre système immunitaire
Notre système immunitaire est là pour combattre les infections qu’elles soient virales, fongiques ou bactériennes. Mais il participe aussi au contrôle des bactéries intestinales. Ce mécanisme fait intervenir la production d’anticorps spécifiques. Ces anticorps de type IgAAbréviation pour Immunoglobuline A, une des formes (ou isoformes) des immunoglobulines (aussi appelées anticorps). Les immunoglobulines sont des protéines produites par des cellules de notre immunité, les lymphocytes B, en réponse à une molécule étrangère, qui peut être une bactérie. Les différentes isoformes (A, G, M…) sont distinguées les unes des autres en fonction de leur rôle. sont déversés dans le tube digestif : ils piègent les bactéries et participent ainsi à leur élimination dans les fèces.
Notre organisme est bien équipé pour combattre l’invasion des bactéries, tout en tolérant leur présence. Parmi cet équipement, nos cellules possèdent des détecteurs de bactéries… plus précisément de certains composants de ces bactéries. Ces détecteurs, appelés récepteurs, vont reconnaître des motifs bactériens comme les lipopolysaccharidesMolécules ayant une partie lipidique et une partie glucidique. (LPS) qui diffèrent en fonction des bactéries [3]. Lorsque ces LPS sont détectés, ils déclenchent une réaction en chaîne qui active le système immunitaire pour juguler l’infection. Les bactéries de notre microbiote intestinal ne dérogent pas à la règle : elles aussi sont dotées de LPS. En revanche, si notre détecteur juge que le LPS détecté ne nécessite pas de déclencher une réponse immunitaire, la bactérie productrice de LPS n’est pas éliminée. Cette tolérance envers nos bactéries intestinales est donc un équilibre fragile ; toute perturbation du microbiote peut engendrer une dérégulation et mener à une activation anormale du système immunitaire.
Les bactéries jouent également un rôle crucial pour éduquer notre système immunitaire. En effet, chez des animaux « axéniques » (dépourvus de microbiotes et donc totalement stériles), le système immunitaire est immature. Ceci prouve que notre propre microbiote éduque notre immunité. L’implantation successive des différentes espèces bactériennes du microbiote à la petite enfance est cruciale pour permettre cette maturation du système immunitaire. Ainsi, perturber cette séquence d’acquisition des espèces bactériennes semble pouvoir modifier cette maturation immunitaire et contribuer au développement de certaines allergies.
Au final, notre organisme doit donc contenir les bactéries du tube digestif et ces dernières se rendre tolérables. Cependant, ces bactéries sont aussi indispensables pour nous apprendre à combattre les bactéries pathogènes.
2.6. Le couple microbiote/cellules intestinales : un dialogue qui s’entend dans tout l’organisme
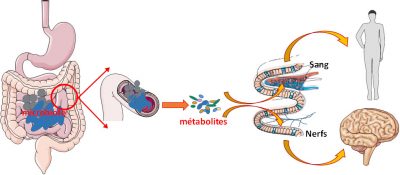
Le couple microbiote/cellules intestinales est efficace pour digérer, absorber et nous fournir des éléments nutritifs. Mais ce couple indissociable est également producteur de signaux qui peuvent se propager à tout l’organisme et avoir des effets à distance. Ces signaux peuvent être envoyés par les bactéries, par leurs métabolites, ou être des fragments de bactéries. Ces signaux peuvent être transportés via les cellules intestinales jusqu’au sang pour aller agir sur nos organes. Mais ces métabolites peuvent également agir sur place. Dans ce cas, l’intestin, très riche en connexions nerveuses, va servir d’intermédiaire : les métabolites produits par les bactéries activent ces connexions nerveuses et transmettent ainsi l’information (Figure 6).
Physiquement cantonné au tube digestif, l’écosystème microbiote/intestin, est ainsi capable d’exercer ses effets non seulement localement, mais aussi à distance via des métabolites et des réseaux de neurones et/ou lenerf vagueEgalement appelé nerf pneumogastrique. Il en existe deux, chacun innervant un coté du corps. Ces nerfs partent du bulbe rachidien, le haut de la moelle épinière, et innervent le cœur, les poumons et l’intestin. Les informations transmises se font de manière inconsciente (autonome).. D’où l’idée que le microbiote intestinal jouerait le rôle de chef d’orchestre dans ce que l’on définit comme l’axe intestin/cerveau.
3. Les perturbations de l’écosystème intestinal : causes du développement de pathologies
Le dialogue et la symbiose qui existent entre le microbiote et l’hôte sont fragiles : toute modification de la composition bactérienne intestinale ou de l’hôte peut perturber l’écosystème. Ces dernières années, grâce aux performances de séquençage à haut débit, la recherche a prouvé que de nombreuses maladies sont associées à une dysbiose : inflammations chroniques de l’intestin, obésité, inflammations du foie (hépatites non virales)…. Mais les dysbioses sont également associées aux maladies cardiovasculaires, aux allergies et à des maladies comportementales ou psychiatriques (stress, dépression, autisme).
Un des grands enjeux actuels est donc de clarifier si la dysbiose est une conséquence de ces diverses maladies ou une des causes. Le rôle causal du microbiote intestinal comme cofacteur dans le développement de nombreuses maladies est d’ores et déjà reconnu ; c’est le cas dans les maladies intestinales inflammatoires chroniques, de certaines pathologies du foie, des maladies cardiovasculaires, de certaines allergies et même des pathologies neurologiques comme l’autisme.
3.1. Microbiote et maladies digestives
Les premières pathologies où le rôle causal du microbiote intestinal a été mis en cause sont des maladies digestives. Certaines bactéries, telle F. prausnitzii, semblent jouer un rôle important dans des maladies chroniques inflammatoires du tube digestif, en particulier dans la maladie de Crohn. Ainsi, les patients les plus graves ou qui rechutent présentent les taux les plus bas de F. prausnitzii. Cette bactérie produit en effet des métabolites qui permettent de modérer l’inflammation et donc de réduire les crises. Les recherches actuelles visent donc à cultiver cette bactérie et à décrypter ses mécanismes d’action. Cependant, cette bactérie très sensible à l’oxygène pose un vrai défi technique aux chercheurs qui butent sur la possibilité de la produire à grande échelle en vue de développer de nouveaux traitements.
3.2. Microbiote et syndrome métabolique
Le syndrome métabolique regroupe un ensemble d’altérations du métabolisme associées à un surpoids ou une obésité. Il engendre diverses complications, notamment des maladies cardiovasculaires et du diabète. Les complications associées à l’obésité s’avèrent liées à une altération de la barrière intestinale et à une diminution de la diversité bactérienne. De plus, quel que soit le traitement, l’amélioration des symptômes est systématiquement associée à une plus grande diversité bactérienne et à une amélioration de la barrière intestinale.
Microbiote et obésité. L’augmentation du nombre d’individus en surpoids ou obèses dans le monde est due à une suralimentation mais aussi à un changement de la qualité nutritionnelle des aliments. Les fibres constituaient près de 60% de l’alimentation il y a encore quelques centaines années : elles ne représentent plus qu’environ 10% de notre ration quotidienne. Cependant, ces changements n’expliquent pas toujours pourquoi certains individus vont développer une plus forte obésité ou les complications qui y sont associées (maladies cardiovasculaires, diabète de type 2Caractérisé par une hyperglycémie chronique, c’est-à-dire que le taux de glucose dans le sang est trop élevé. L’insuline qui régule ce taux de glucose dans le sang est toujours produite mais elle n’arrive plus à agir sur les organes, on parle d’insulino-résistance.). Compte tenu des différentes fonctions assurées par le microbiote intestinal, notamment métaboliques, son rôle dans l’obésité est largement étudié.
L’obésité est associée à une baisse de la diversité des espèces bactériennes et donc des gènes bactériens présents dans le microbiote intestinal. Le microbiote d’un patient obèse peut rendre obèses des souris à qui on le transplante. Par ailleurs, chez des individus obèses, un régime amaigrissant sera d’autant plus efficace que sa diversité bactérienne est élevée. Il est donc aujourd’hui évident que le microbiote joue un rôle dans la prise de poids. En revanche, si la présence des bactéries intestinales A. Muciniphila et F. prausnitzii semblent associées à un profil bénéfique du microbiote intestinal, elles ne peuvent contrecarrer la dysbiose à elles seules.
Maladies cardiovasculaires et diabète de type 2. Parmi les complications fréquemment associées à l’obésité, on trouve les maladies cardiovasculaires et le diabète de type 2. Cependant, tous les individus en surpoids ou obèses ne développent pas ces complications. Outre leur héritage génétique, le microbiote intestinal participe à la susceptibilité individuelle face à ces complications.
Des changements de composition bactérienne du microbiote intestinal ont été observés chez les patients atteints de diabète de type 2. Certaines espèces sont particulièrement diminuées chez ces patients. Parmi elles : F. prausnitzii et des bactéries du genre Roseburia. Akkermansia Muciniphila est elle aussi diminuée ; et comme dans l’obésité, son administration à des rongeurs réduit clairement l’insulino-résistance. Mais les interactions entre les métabolites produits par le microbiote intestinal et les fonctions de notre organisme commencent tout juste à être décryptées, laissant entrevoir la complexité de l’influence de l’écosystème hôte/bactéries pour certaines pathologies.
Parmi les complications du syndrome métabolique, les maladies cardio-vasculaires restent à ce jour la première cause de mortalité en France. Dans ces pathologies, des plaques d’athéromePlaques constituées de constituants divers (cholestérol, débris cellulaires et calcium) qui vont se déposer sur l’artère et contribuer à ce qu’elle se bouche. Lorsque la plaque obstrue le vaisseau, on parle de thrombose. L’athérome est la cause dominante de la majorité des affections cardio-vasculaires. peuvent se rompre et former des caillots obstruant les vaisseaux sanguins. Or les bactéries intestinales jouent un rôle dans la constitution de ces plaques. En effet, selon les bactéries hébergées dans notre tube digestif, certains composés alimentaires conduisent à la formation de molécules qui favorisent la plaque d’athérome (TMATriméthylamine ensuite transformé par le foie en TMAOOxyde de Triméthylamine). Ainsi, la consommation de produits carnés contenant de la cholineNutriment qui va être incorporé dans différentes molécules biologiques présentent dans notre organisme. Parmi elles, la lécithine est un phospholipide qui contient entre autre de la choline., de la lécithine ou de la carnitineAcide aminé non essentiel. favorise cette production. On a aussi retrouvé des bactéries directement dans ces plaques dont l’origine semble plutôt buccale qu’intestinale.
Si le régime méditerranéen riche en fibres a un effet bénéfique sur le risque cardio-vasculaire, aucune bactérie impliquée dans cet effet bénéfique n’a encore été identifiée. Utilisés comme probiotiques dans des études sur des rongeurs, certains Lactobacilles ont aussi montré quelques effets bénéfiques sur la fonction cardiaque. Au final, si le rôle du microbiote intestinal semble avéré dans le développement des complications cardio-vasculaires, des traitements agissant sur les bactéries restent à développer.
3.4. Microbiote et maladies neurologiques
La communication entre nos bactéries intestinales et notre cerveau passe par des métabolites extrêmement variés que celles-ci peuvent produire. Comme nous l’avons décrit dans le chapitre 2.6, ces métabolites jouent un rôle sur nos neurones, en passant par le sang ou en agissant directement sur des terminaisons nerveuses de notre tube digestif. De plus, il a été démontré que la nature de notre microbiote intestinal peut jouer sur l’étanchéité de la barrière hémato-encéphalique ; cette barrière protège notre cerveau en limitant le passage de nombreuses substances qui pourraient avoir un effet néfaste sur son fonctionnement.
Les dernières avancées ont montré que la nature des bactéries intestinales a un effet sur l’état d’anxiété et de stress mais aussi au cours de la dépression. Chez des rongeurs, des supplémentations en lactobacilles ou en bifidobactéries (en particulier B. infantis) semblent améliorer les symptômes dépressifs. Si des niveaux bas en certaines bactéries sont observés au cours de la dépression (ex : F. prausnitzii), on ne sait pas encore si cette diminution est directement responsable des symptômes dépressifs.
On a aussi observé des dysbioses associées à certaines pathologies neurodégénératives : maladies de Parkinson, maladie d’Alzheimer et sclérose en plaque. Cependant, on ne sait pas encore dans quelle mesure cette dysbiose accompagne et contribue à ces maladies.
4. Le microbiote, une cible thérapeutique d’avenir
Restaurer l’équilibre de l’écosystème intestin/microbiote est donc un véritable enjeu pour développer de nouveaux traitements. En attendant, l’alimentation est déjà un formidable levier pour influencer notre microbiote. Par exemple, un apport en fibres suffisant dans notre alimentation permet de favoriser la croissance d’un grand nombre d’espèces bactériennes. On pourrait aussi apporter des bactéries manquantes ou déficientes dans certaines pathologies, par des aliments fermentés ou des compléments alimentaires riches en bactéries. Parmi les fibres, certaines ont déjà démontré leurs actions bénéfiques sur l’hôte en modulant le microbiote intestinal : ce sont les prébiotiques.
Les bactéries intestinales aux effets bénéfiques pour notre santé pourraient être consommées sous forme de compléments alimentaires. De quoi palier leur absence ou leur baisse observée dans certaines pathologies. Par exemple, la bactérie F. prausnitzii est dominante chez un individu en bonne santé… mais se trouve faiblement présente dans de nombreuses pathologies, notamment les maladies inflammatoires chroniques de l’intestin (MICI).
L’utilisation du microbiote intestinal dans des protocoles de soin est déjà entrée dans la pratique courante à l’hôpital. Des transferts de microbiote sont par exemple prescrits pour soigner des infections récurrentes à C. difficile, réfractaires aux traitements antibiotiques classiques. Dans la pratique, cela consiste à transférer les matières fécales d’un donneur sain pour ré-ensemencer l’intestin du receveur. Après ce transfert fécal, les patients ne récidivent plus de leur infection à C. difficile. L’écosystème du microbiote est donc bel et bien déjà utilisé comme stratégie thérapeutique. Le recours à cette technique de transfert fécal sera sans doute élargi à d’autres situations pathologiques.
Autant de stratégies thérapeutiques fondées sur la restauration d’un équilibre de l’écosystème intestin/microbiote essentiel au bon fonctionnement de notre organisme [4].
Image de couverture : Peinture de Teppei Ikehila : Fasciné par la magie des bactéries, petites cellules capables de se reproduire à l’infini, de formes et de couleurs extraordinaires, Teppei Ikehila en fait un thème d’inspiration privilégié.
[1] Voir par exemple : Human Microbiome Project (http://hmpdacc.org/), Metahit (http://www.metahit.eu/)
[2] Chez les ruminants les archées peuvent représenter de 0,3 à 3,3% des bactéries de l’estomac ou rumen. Chez l’homme, la présence d’archées au sein du microbiote intestinal ne semble pas systématique. Cependant, il existe sans doute un biais dans la mesure où beaucoup d’études n’incluent par leur étude.
[3] Ces récepteurs sont des récepteurs « Toll-like » ou TLR lorsqu’ils sont présents au niveau de la membrane des cellules. Ils peuvent également être présents dans les cellules et reconnaître des motifs bactériens de types peptidoglycanes. Il s’agit alors de récepteurs NOD.
[4] Kapel et al. (2014) Practical implementation of fecal transplantation. Clin Microbiol Infect. 20(11):1098-1105 ; French Group of Faecal microbiota Transplantation (FGFT) (2016) Faecal microbiota transplantation in recurrent Clostridium difficile infection: Recommendations from the French Group of Faecal microbiota Transplantation. Sokol Dig Liver Dis. 48(3):242-247.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : CASSARD Anne-Marie, THOMAS Muriel (8 février 2019), Les microbiotes humains : des alliés pour notre santé, Encyclopédie de l’Environnement. Consulté le 20 janvier 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/les-microbiotes-humains-des-allies-pour-notre-sante/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.