Pandémies virales de l’ère moderne
PDF
Depuis la grippe espagnole de 1918, le terme pandémie est devenu courant. Les dernières pandémies infectieuses ont été toutes d’origine virale. La dernière est celle de la CoVid-19 que nous vivons actuellement, et toutes ont pour origine l’animal : elles appartiennent donc au groupe des zoonoses, maladies qui lient espèces sauvages, animaux domestiques et humains. Les virus sont des micro-organismes, dont la seule exigence est de se perpétuer. Les chauves-souris se sont adaptées à SARS-Cov-1 et Cov-2, certains singes de l’ancien monde au VIS, proche du VIH, sans périr. Mais ils font peser de sérieuses menaces sur l’humanité. Le virus de la variole ne fut-il pas le plus grand tueur de l’humanité avant l’éradication de cette pathologie ? Ebola n’a-t-il pas explosé en épidémies massives dans les grandes villes d’Afrique et réussi à atteindre d’autres continents ? Les Coronavirus ont réussi à franchir la barrière d’espèce en passant des animaux aux humains, ils infectent des cellules pour se multiplier et finissent par tuer la personne malade (Ebola, MERS-Cov, etc). Le malade guérit lorsque l’organisme infecté répond à l’agression en synthétisant des anticorps aptes à neutraliser l’agent infectieux. Sinon, la maladie devient chronique et peut emporter l’hôte (VIH et SIDA).
- 1. Historique : de quoi « pandémie » est-elle le nom ?
- 2. Quelles furent les grandes pandémies virales de l’ère moderne ?
- 3. Comment démarre une pandémie virale ?
- 4. Les mécanismes de l’émergence au niveau moléculaire
- 5. Les futures menaces pandémiques?
- 6. Quels sont les « réservoirs de virus » ?
- 7. Réduire la propagation d’une pandémie virale
- 8. Messages à retenir
1. Historique : de quoi « pandémie » est-elle le nom ?

Etymologiquement, pandémie dérive du grec ancien « pan » : tout et « demos » : peuple, population. C’est donc une sorte de superlatif d’épidémie ; une « épidémie étendue à toute la population d’un continent, voire au monde entier » (Dictionnaire Larousse 2020). Le mot « pandémie » (pandemic en anglais) est employé pour la première fois en 1666 par le médecin britannique Gideon Harvey dans son livre sur la tuberculose, Morbus Anglicus ou the Anatomy of Consumptions, écrit peu après la peste noire de Londres (1665-66) qui décima près de 20% de la population (Figure 1). Pour Harvey, « consumption » correspondait à la « phtisie », terme désignant la tuberculose et désormais obsolète. Il faudra attendre 1828 pour que le mot pandemic entre dans le dictionnaire « An American Dictionary of the English Language » écrit par Noah Webster. [1]
Au début du XIXe siècle, épidémie et pandémie sont des termes synonymes. Il faudra attendre les ravages provoqués par le choléra (1817-1860), qui fit 1,2 million de morts dans le monde, pour que le mot « pandémie » soit employé par la presse pour qualifier la propagation mondiale de cette maladie.
Ainsi, lorsque survint la pandémie de grippe de 1889, ce concept existait déjà. Le terme « pandemic », s’impose pour décrire l’émergence d’une épidémie mondiale de grippe, comme en témoigne un article de la revue médicale britannique The Lancet (1894), comportant le mot « pandemic » dans son titre [2]. Puis explosa la « grippe espagnole » de 1918-20. Elle tua cinq fois plus que la Grande Guerre et fit dans le monde entre 20 et 50 millions de morts.
Après les grandes pandémies historiques (peste, variole, choléra, typhus…) qui sévirent jusqu’au 19e siècle, le monde a subi plusieurs pandémies notables, notamment, la grippe espagnole et le syndrome d’immunodéficience acquise (SIDA). Les pandémies qui émergent au 20e siècle sont quasiment toutes d’origine virale, les infections d’origine bactérienne étant généralement maitrisées avant qu’elles ne deviennent épidémiques [3].
Le Tableau 1 résume les pandémies virales et les épidémies auxquels l’humanité a dû faire face depuis la première guerre mondiale. Elles peuvent provoquer une morbidité et une mortalité soudaines et généralisées ainsi que des perturbations sociales, politiques et économiques.
Tableau 1. Les pandémies virales de l’ère moderne (1918 à nos jours).
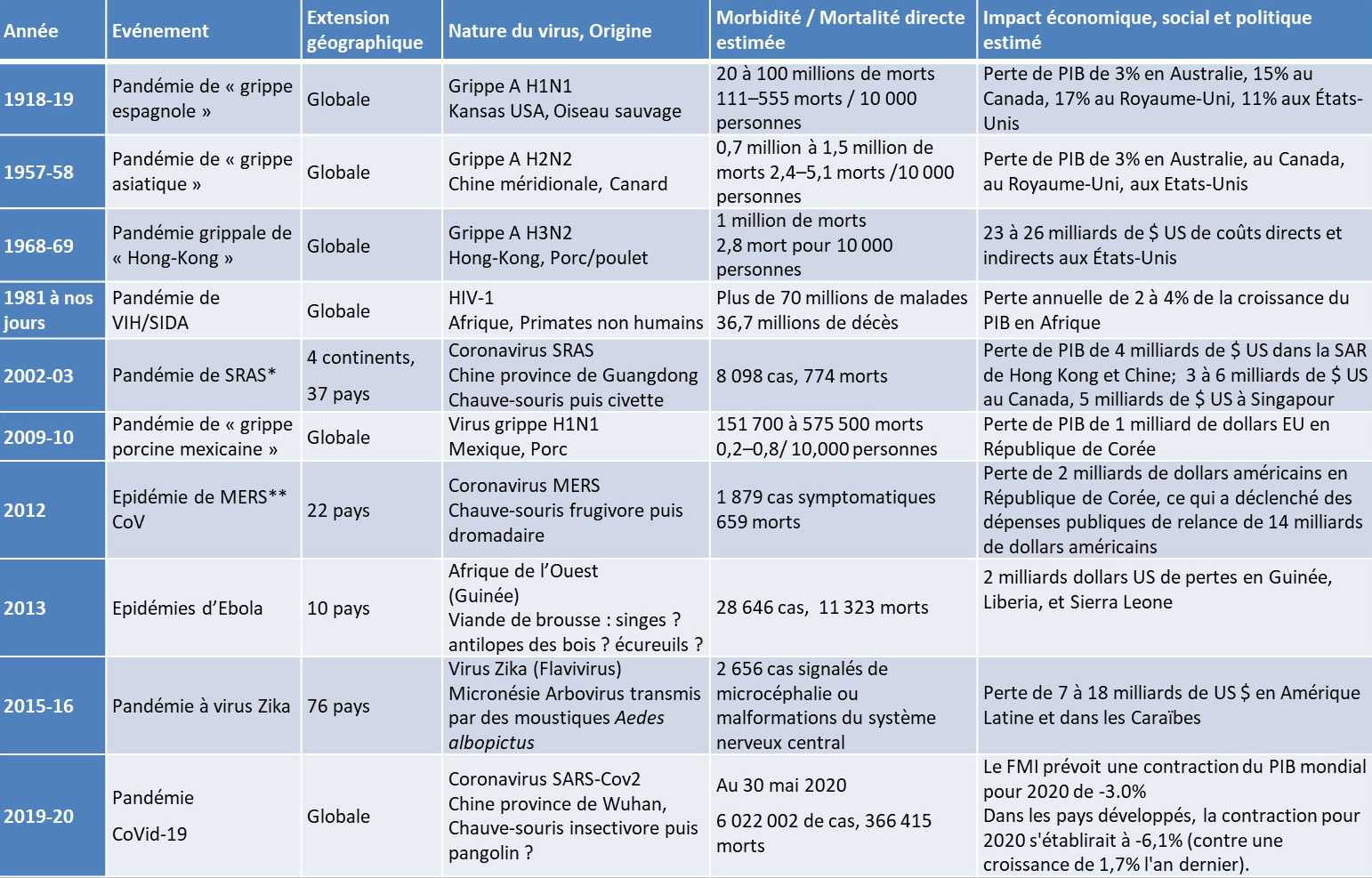
* MERS = Middle East respiratory Syndrome ; ** SARS = Severe acute respiratory syndrome. Concernant le SARS-CoV et le MERS-CoV, ceux-ci étaient beaucoup plus virulents et moins contagieux que le nouveau coronavirus, le SARS-CoV-2. La létalité du SARS est de 7 %, celle du MERS de 30 %, contre 0,7 % pour le nouveau coronavirus.
En remontant le fil du temps, et en dehors de l’épisode actuel de la Covid-19, les pandémies les plus notables depuis une centaine d’années sont les suivantes :
- La « grippe mexicaine» de 2009-20 (virus Influenza A H1N1). Le bilan fut de 18 500 morts selon l’OMS mais 10 à 30 fois plus selon la revue The Lancet. Apparue au Mexique fin mars 2009 dans des élevages intensifs de porcs, elle est d’abord nommée « grippe porcine » par l’OMS. L’alerte pandémique est lancée le 11 juin 2009. Des campagnes massives de vaccination sont organisées à la hâte. Mais ce virus s’avère finalement bien moins meurtrier que redouté. Après coup, les pays occidentaux, en particulier européens, et l’OMS sont critiqués pour une mobilisation jugée surdimensionnée, alors que chaque année, la grippe dite saisonnière fait entre 250 000 et 500 000 morts, selon cet Organisme.
- La pandémie de coronavirus SRAS (Syndrome Respiratoire Aigu Sévère 2002-2003) émergea fin 2002 dans le sud de la Chine. Le virus s’avère redoutablement contagieux, provoquant des pneumonies aigües souvent mortelles. A partir du printemps 2003, il déclenche une véritable psychose en Asie. Le SRAS touchera finalement une trentaine de pays, mais avec un bilan limité (774 morts), la Chine et Hong Kong concentrant 80% des victimes et un taux de mortalité de 9,5%.
- La grippe aviaire de 2003-2004 (virus Influenza A H5N1) n’a fait « que » 400 morts. Elle ravagea d’abord les élevages de poulet de Hong-Kong avant de se transmettre à l’Homme (cf § 6.2 L’élevage industriel). Étant donné le pouvoir hautement virulent de la souche H5N1, cette épidémie déclencha une psychose générale et l’OMS décréta « une urgence de santé publique de portée mondiale ». Les experts estiment que ce virus représente une menace pandémique majeure pour les années futures.
- La pandémie du SIDA liée au Virus de l’Immunodéficience Humaine (VIH) est apparue en 1981. Le bilan à ce jour est colossal : 37 millions de morts selon ONUSIDA… En 2018, 770 000 personnes décédèrent d’infections opportunistes liées à l’immunodépression, car le virus attaque le système immunitaire. Grâce aux immenses progrès de la recherche, 24,5 millions de personnes ont désormais accès aux traitements antirétroviraux qui, pris régulièrement, bloquent très efficacement la maladie et réduisent fortement les risques de contamination.
- La « grippe de Hong-Kong» (virus Influenza A H3N2) fit le tour du monde entre l’été 1968 et le printemps 1970 ; elle cibla essentiellement les enfants. Parti de Hong-Kong, le virus traversa d’abord l’Asie puis, fin 1968, les États-Unis ; il déferla sur l’Europe fin 1969. Bilan : un million de morts selon l’organisme américain de surveillance et prévention des maladies (Centers for Disease Control and prevention, CDC). Pour les épidémiologistes, cette grippe entra dans l’histoire comme la première pandémie de l’ère moderne, celle des transports aériens intercontinentaux.
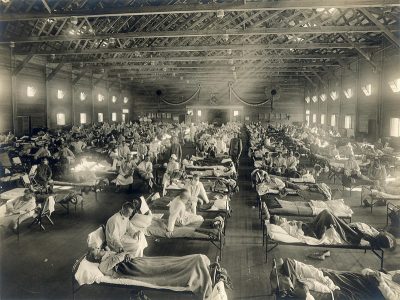
Figure 2. Un hôpital d’urgence près de la base militaire américaine de Fort Riley (Kansas) accueille les malades de la grippe espagnole en 1918. [Source : Otis Historical Archives, National Museum of Health and Medicine / Public domain] - La « grippe asiatique» (virus Influenza A H2N2) partit d’une province méridionale de la Chine en février 1957 et frappa en deux vagues très virulentes. Il a fallu plusieurs mois avant qu’elle n’atteigne l’Amérique et l’Europe. Les personnes âgées chez qui elle entraînait de graves complications pulmonaires, en furent les principales victimes : 1,1 million de morts selon le CDC.
- Première grande pandémie du 20e siècle, la grippe dite « espagnole » (virus Influenza A H1N1) [4], qui sévit de mai 1918 à avril 1919, fut un des pires cataclysmes sanitaires de l’histoire de l’humanité. Tout commença aux États-Unis dans un camp militaire du Kansas (Figure 2). Puis le virus, se propagea de façon fulgurante : d’abord en Europe avec les soldats américains puis via le flot ininterrompu de réfugiés, de malades, de prisonniers, et enfin sur tous les continents. Cette pandémie toucha le tiers de l’humanité, tuant près de 50 millions de personnes et faisant cinq fois plus de victimes que la Grande Guerre (2,5% de la population mondiale)…. Comme l’a écrit le microbiologiste Patrick Berche « Rien n’a pu l’arrêter…..ni les forêts tropicales, ni les montagnes, ni la jungle, ni même les glaces de l’Arctique» ; des populations autochtones entières disparurent [5]…
Présents partout dans notre environnement, les virus ne sont pas des organismes vivants autonomes. Ils doivent nécessairement infecter des organismes vivants – animaux, plantes, champignons- pour pouvoir se multiplier. Les virus ne sont pas stables : ils évoluent au cours de ce cycle infectieux. Parfois, ils rencontrent des impasses immunitaires et disparaissent. Mais il arrive qu’à la faveur d’une « épizootie » — maladie frappant une espèce animale déterminée — la maladie devienne une « zoonose » c’est-à-dire une maladie qui se transmet d’animaux à l’Homme, et vice versa. La plupart des nouvelles pandémies virales [6] sont nées ainsi, de la transmission « zoonotique » d’agents pathogènes des animaux aux humains [7],[8], ce qui fait dire aux scientifiques « que la prochaine pandémie sera probablement une zoonose ».
Les animaux domestiques (porcs, volailles d’élevage) et/ou animaux sauvages sont la porte d’entrée des zoonoses dans les populations humaines (cf § 6.2). Introduites après la domestication grâce à une interaction animal-homme accrue, des zoonoses potentiellement à haut risque (y compris les grippes aviaires) continuent à émerger à partir de systèmes de production animale [9],[10]. La chasse, la consommation de « viande de brousse », le braconnage et le commerce d’espèces sauvages furent à la source d’émergence de certains agents pathogènes présents dans des réservoirs fauniques (exemple du virus Ebola [11]).
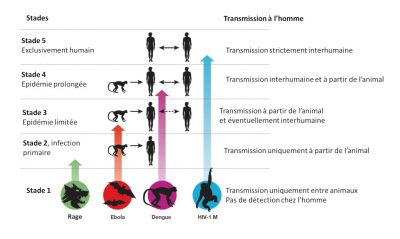
- Stade 1. Des virus présents chez les animaux n’ont pas été détectés chez l’homme dans des conditions naturelles, néanmoins ils peuvent se transférer par inadvertance (les greffes d’organes ou les aiguilles hypodermiques). Exemples : certains types de grippe aviaire type A H7N1 et H7N3 ;
- Stade 2. Un agent pathogène des animaux, dans des conditions naturelles, transmis d’animaux à l’homme (Infection primaire) mais n’a pas été transmis entre humains (Infection secondaire). Exemples : Virus Nipah, Rage et virus du Nil occidental ;
- Stade 3. Agents pathogènes animaux ne pouvant subir que quelques cycles de transmission secondaire entre humains, de sorte que les épidémies humaines occasionnelles déclenchées par une infection primaire disparaissent rapidement. Exemple : virus Ebola.
- Stade 4. Maladie qui existe chez les animaux et qui a un cycle sylvatique [12] d’infection de l’homme par transmission primaire à partir de l’hôte animal (4a : Dengue dans les zones boisées de l’Afrique de l’Ouest et Asie du Sud-Est), mais aussi qui subit également de longues séquences de transmission secondaire entre humains sans l’implication d’hôtes animaux (4b : Grippe A, choléra, typhus)
- Stade 5. Agent pathogène exclusif aux humains. Exemples : Paludisme à P. falciparum, rougeole, oreillons, rubéole, variole et syphilis.
La plupart des agents pathogènes zoonotiques ne sont pas bien adaptés aux humains (stades 2 à 3), ils ne font qu’apparaître sporadiquement au travers « d’événements de débordement » (« spillover » en anglais) et conduisent éventuellement à des épidémies localisées appelées « chaînes de bégaiement » [13].
Ces épisodes dits de « bavardage viral » augmentent le risque de pandémie, dans le sens où ils offrent aux virus la possibilité de s’adapter peu à peu à une propagation au sein de la population humaine. Les agents pathogènes qui ont dépassé le stade 3 sont les plus préoccupants, car ils sont suffisamment bien adaptés pour provoquer de longues chaînes de transmission entre humains (directement ou indirectement grâce à des vecteurs), leur propagation géographique dans l’environnement n’étant pas limitée par la gamme d’habitat d’un réservoir animal.
4. Les mécanismes de l’émergence au niveau moléculaire
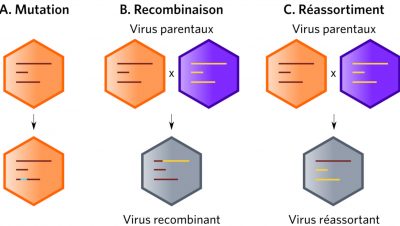
La variabilité génétique des virus (essentiellement les virus à ARN) découle de l’action cumulée des mutations, recombinaisons ou réassortiments des génomes viraux (Figure 4). Les mutations se produisant en permanence, elles maintiennent des sous populations sélectionnables lors de l’introduction d’un virus dans un nouvel hôte. Elles permettent par exemple de faire face aux pressions de sélections, qu’elles soient naturelles ou artificielles comme l’adaptation du VIH-1 aux facteurs de restrictions. Parmi les virus grippaux (virus à génome ARN segmenté), seules les souches de type A sont responsables de pandémies. Les mécanismes en cause sont essentiellement des mécanismes de réassortiments génétiques associés à des mutations (Lire Polymorphisme génétique et variation).
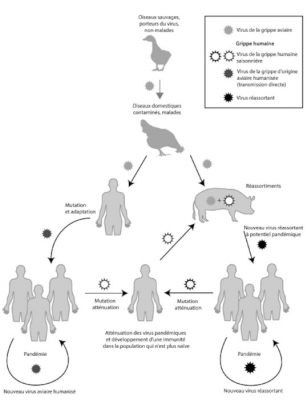
(i) A gauche sur la figure 5, apparaissent les mécanismes d’adaptation par voie directe via des mutations. C’est principalement par ce processus qu’en 1918, un virus H1N1 étroitement apparenté aux virus aviaires s’est adapté pour se répliquer efficacement chez l’homme. Le risque pour les années futures est qu’un scénario identique se reproduise dans le futur avec les souches type A H5N1 ou H5N8 (ou autres).
(ii) A droite sur la figure 5 apparaissent, l’adaptation des virus grippaux de type A via les réassortiments chez un hôte intermédiaire. Le plus souvent c’est le porc (Lire focus Les réassortiments génomiques).
De futures souches grippales pandémiques pourraient survenir par l’un ou l’autre des deux scénarios.
5. Les futures menaces pandémiques?
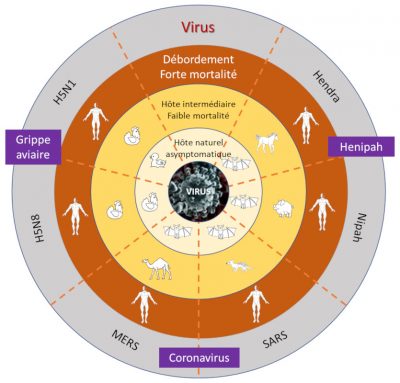
Il faut distinguer trois grandes catégories de menaces pandémiques :
- Des agents pathogènes ayant un potentiel élevé de déclencher des pandémies graves. Ce groupe comprend les virus de la grippe pandémique : la transmission interhumaine de type respiratoire est très efficace, les périodes d’incubation sont longues, ce qui facilite la circulation des personnes infectées sans qu’elles soient détectées et enfin leur profil symptomatique atypique est un véritable défi pour le diagnostic différentiel (en particulier dans les premières périodes d’infection).
- Des virus représentant une menace mondiale modérée. Ce sont par exemple le virus Nipah et les virus grippaux type A H5N1, H5N8 et H7N9 : ils n’ont pas montré jusqu’à présent de transmission interhumaine soutenue, mais ils pourraient à la faveur de mutations ou d’adaptation, être transmis plus efficacement (cf § 6.2).
- Des agents pathogènes tels les virus Ebola, Marburg ou Lassa ont le potentiel de provoquer des flambées épidémiques régionales ou interrégionales. Elles sont souvent favorisées par l’extrême pauvreté, l’instabilité politique et la pauvreté du système sanitaire. Mais le risque d’une diffusion mondiale est limité en raison de la lenteur de la transmission, de la forte probabilité d’une détection rapide et de l’efficacité des mesures de confinement.
6. Quels sont les « réservoirs de virus » ?
6.1. La faune sauvage : un réservoir inépuisable…
L’espèce humaine est probablement l’espèce animale la plus parasitée sur terre, avec près de 1 400 espèces de parasites et agents pathogènes [15], plus de 60% d’entre eux étant d’origine zoonotique. La relation Homme-Animal est donc essentielle à la compréhension du fardeau épidémiologique humain, comme l’ont souligné les travaux d’historiens [16], de biogéographes [17] et d’épidémiologistes [18].
Les primates non-humains. Le lien épidémiologique entre animaux et homme doit se comprendre dans le temps évolutif long, avec l’importance des liens de proximité phylogénétique avec les primates non-humains, c’est-à-dire l’apparentement entre espèces issues de l’évolution, et dans le temps écologique et historique plus récent avec la révolution néolithique et la domestication animale.
L’espèce humaine partage un nombre considérable de parasites, virus et bactéries pathogènes avec les primates non-humains [19]. La proximité phylogénétique et la proximité écologique, c’est-à-dire la coexistence dans les mêmes environnements d’espèces apparentées par une histoire évolutive commune, sont les deux facteurs explicatifs du partage de ces agents pathogènes entre primates humains et non humains. Cette coévolution se retrouve dans des traits communs partagés, physiologiques et biologiques, permettant à de nombreux agents infectieux issus des primates non-humains de pouvoir infecter les humains. Le cas du HIV, ayant évolué à partir de souches de primates (chimpanzés pour le HIV1 et macaques pour le HIV2) est intéressant. Pour ces sauts d’espèces, il aura fallu (i) du temps, (ii) un environnement favorable, (iii) une proximité intime et (iv) des contacts nombreux et répétés pour que cet agent infectieux s’adapte aux humains pour donner une nouvelle maladie infectieuse : le SIDA [20].
Pour des pathogènes autres que les virus, une espèce Plasmodium rencontrée dans le paludisme humain, Plasmodium knowlesi, décrit au siècle dernier en Asie du Sud-Est chez le macaque crabier (Macaca fascicularis) a été retrouvée dans les années 2004-2008 chez des personnes présentant des fièvres.
Les arbovirus et les virus de la famille des Flaviviridae, avec les virus agents de la Fièvre Jaune, de la Dengue, et du Zika, sont tous des virus de primates non-humains africains :
- Le virus Amaril -agent de la fièvre jaune- transmis par le moustique Aedes aegypti, a pour principaux hôtes-réservoirs des singes cercopithèques et colobes. Les études phylogénétiques suggèrent son émergence en Afrique de l’Ouest, il y a seulement 1 500 ans [21]. L’extension de la fièvre jaune au continent américain est consécutive aux traites esclavagistes et à l’introduction du virus et du moustique dans les Amériques. Le virus est ensuite passé chez les singes sud-américains.
- Le virus Chikungunya (famille des Togaviridae) a émergé en 1950 en Tanzanie. Les hôtes primaires sont des primates non-humains d’Afrique centrale ou orientale et les vecteurs des moustiques Aedes africanus ou Aedes furcifer. De multiples épidémies ont éclaté par la suite, dont celle de La Réunion -entre mars 2005 et avril 2006- avec 525 000 cas pour une île de 800 000 habitants.
- Le virus Zika issu de macaques est également apparu en Afrique dans les années 1950 pour s’étendre à de nombreux pays de la zone intertropicale. Une épidémie massive a affecté le Brésil en 2015–2016 avec plus de 700 000 cas [22], avec pour conséquence de nombreuses microcéphalies chez les nourrissons infectés in utero [23]. Cet arbovirus est transmis par le moustique Aedes albopictus. Les facteurs déclenchant l’épidémie résultent de la combinaison :
- de la déforestation massive ;
- de feux de forêts attisés par une période de sécheresse intense ;
- d’une modification du comportement des moustiques qui ont reporté leurs repas sanguins vers les humains du fait l’effondrement de la faune de singes locaux, réservoirs du virus.
On retrouve ainsi dans cette étude l’importance des primates non-humains dans les maladies zoonotiques virales.
Les rongeurs. Avec les primates, les rongeurs forment les groupes réservoirs qui contribuent le plus au partage des virus, loin devant les chauves-souris. La place des rongeurs s’explique par leur importance numérique et spécifique (premier groupe de mammifères par le nombre d’espèces), mais surtout par le commensalisme de nombreuses espèces. Rats et souris ont commencé leur cohabitation avec les humains depuis les premières sédentarisations, la naissance de l’agriculture et les premières cités agrariennes. Ils ont ensuite colonisés l’ensemble de la planète avec les mondialisations successives emportant avec eux parasites et microbes pathogènes, comme la bactérie agent de la peste ou la rickettsie responsable du typhus murin.

- La rage, maladie zoonotique due à un Lyssavirus (famille des Rhabdoviridae) originaire de chauves-souris [24] (Figure 6). Les cas de rage humaine consécutifs à une morsure de chauve-souris restent marginaux en comparaison des cas liés aux morsures de chiens.
- La transmission des virus Ebola (famille des Filoviridae) hébergés chez les chauves-souris est souvent consécutive à des manipulations de viande de brousse sur les marchés, comme dans le cas démontré de primates infectés en République Démocratique du Congo (RDC).
- Les apparitions du virus Ebola sont plus fréquentes dans les zones d’Afrique centrale et de l’Ouest qui ont récemment subi des déforestations [25]. Lorsqu’on abat les forêts qui leur servent de gite, on contraint les chauves-souris à aller se percher sur les arbres dans les jardins et les fermes. Dès lors, un humain ingère de la salive de chauve-souris en mordant dans un fruit souillé ou en tentant de tuer la visiteuse importune, s’exposant ainsi aux microbes qui ont trouvé refuge dans ses tissus. C’est ainsi qu’une multitude de virus dont les chauves-souris sont porteuses saines parviennent à pénétrer des populations humaines.
- Depuis l’émergence en Australie (1994) du virus Hendra (famille des Paramyxoviridae), hébergé chez des grandes chauves-souris frugivores, toutes les épidémies ont touché des chevaux. Certaines d’entre elles ont aussi touché des humains qui étaient en contact direct avec les chevaux infectés [26].
- L’émergence du virus Nipah (proche du virus de la rougeole, famille des Paramyxoviridae) en Malaisie en 1998 est consécutive à l’infection des porcs en élevage puis des humains, à partir de chauves-souris roussettes frugivores [27]. En revanche, les épidémies de virus Nipah qui suivirent au Bangladesh et en Inde sont directement issues des chauves-souris, avec des transmissions interhumaines avérées [28] (Figure 7) [29].
- Le coronavirus du SRAS (Syndrome Respiratoire Aigu Sévère) en 2002 avec plus de 8 000 personnes infectées dans une trentaine de pays. Hébergé chez des chauves-souris insectivores, il a émergé dans la province de Guangdong en Chine avec comme hôte intermédiaire le passage sur une civette, vendue sur des marchés dans le sud de la Chine.
- Le virus du MERS (Middle East Respiratory Syndrome) en 2012. Le premier cas d’infection humaine par le coronavirus responsable du MERS est apparu en Arabie Saoudite [30] et impliqua des chauves-souris insectivores comme réservoirs et des dromadaires comme hôtes intermédiaires. Des transmissions interhumaines furent ensuite identifiées avec des cas importés en Europe, en Asie et aux États-Unis.
- Le virus SARS-cov2 responsable de la Covid-19 a émergé en 2019-20. Son hôte réservoir est certainement une chauve-souris insectivore mais dont l’hôte intermédiaire, peut être un pangolin, est toujours sujet à débats scientifiques [31].
6.2. L’élevage industriel : un danger explosif à nos portes
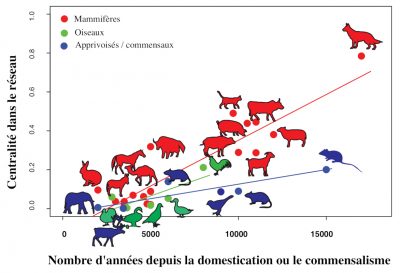
L’historien William McNeill fut le premier à suggérer que l’acquisition des pathogènes est directement liée à l’histoire de domestication animale [32] (Figure 8). Cette hypothèse [33], confirme l’existence d’une relation positive significative entre le temps écoulé depuis le début de la domestication d’un animal et le nombre de maladies infectieuses et parasitaires qu’il partage avec les humains [34].
Parmi les mammifères réservoirs de virus à ADN et à ARN susceptibles d’infecter les humains, les ongulés (dont le bétail) et les carnivores (dont le chien et le chat) jouent un rôle actif dans la transmission de ces pathogènes. [35]
- Identifié pour la première fois à Hong-Kong en 1997, il arriva en Europe en 2005 et infecta les élevages de volailles en particulier dans l’Est de la France. Ces virus -hébergés par le gibier d’eau- font des ravages dans les élevages de poulets en captivité chez qui les virus mutent et deviennent plus virulents — un processus si prévisible qu’il peut être reproduit en laboratoire [36].
- En 1957, la recombinaison de virus de grippes animales et humaines suivie d’une mutation, causa la pandémie de grippe asiatique (cf Tableau 1, Figure 5 et focus Les réassortiments génomiques), responsable de la mort d’au moins 1 million de personnes.
- En 2009, une nouvelle « combinaison » de virus grippaux d’origine aviaire, porcine et humaine survint et provoqua entre 150 000 et 500 000 morts selon les sources.
Le virus grippal A H5N1 se transmet directement des oiseaux aux humains, sans passer par le porc qui en atténuerait la létalité. On l’a vu lors de la pandémie de grippe A H1N1 de 2009 [37] qui causa moins de décès qu’annoncé. Du fait de l’écart entre les espèces-hôtes qu’il traverse (oiseau – homme), le H5N1 suscite chez les humains des réactions inflammatoires aiguës, tuant les deux tiers des personnes qu’il infecte. En 2014, en Amérique du Nord, il fallut abattre des dizaines de millions de volailles pour enrayer la propagation d’une telle souche [38]. Actuellement en France, la grippe aviaire s’intensifie.
On assiste aussi à une offensive du virus grippal type A H5N8, qui justifia l’abattage massif des canards d’élevage dans le Sud-Ouest. Arrivé en Europe depuis l’Asie début 2015, le virus H5N8 déclenche une épizootie -comme le virus H5N1-, mais il ne se transmet pas des oiseaux aux humains. Il est hautement pathogène chez les volailles domestiques dont il détruit le système digestif – et non le système respiratoire comme le fait le virus grippal chez l’Homme. Les autorités sanitaires redoutent qu’il ne se recombine avec le H5N1 et arrive ainsi à passer chez l’homme !
Pour conclure, la multiplication des élevages industriels porte en partie la responsabilité des nouvelles maladies infectieuses [39]. Virologues et vétérinaires s’alarment sur le risque majeur des élevages industriels de volailles ou de porcs (Figure 9).

Établir des armes pour nous protéger et des règles pour un futur ambitieux est une nécessité. Mais est-ce possible ? Il s’agirait :
- De protéger les habitats sauvages et faire en sorte que les animaux gardent leurs microbes au lieu de nous les transmettre, comme s’y efforce notamment le mouvement « One Health » (Un monde, une santé) [41] ;
- De mettre en place une surveillance étroite des milieux dans lesquels les microbes des animaux sont les plus susceptibles d’évoluer en pathogènes humains et de tenter d’éliminer ceux qui montrent des velléités d’adaptation à l’organisme humain, avant qu’ils ne déclenchent des épidémies.
C’est précisément ce à quoi s’attellent depuis dix ans les chercheurs du programme Predict, financé par l’Agence des États-Unis pour le développement international (USAID) [42]. Plus de neuf cents nouveaux virus liés à l’extension de l’empreinte humaine sur la planète, parmi lesquels des souches jusqu’alors inconnues de coronavirus comparables à celui du SRAS [43], ont déjà été identifiés !
Au moment où les pandémies se déclarent, l’Histoire montre :
- Qu’il n’existe jamais ni vaccin immédiatement disponible, ni traitement antiviral efficace ;
- Que la fréquence des pandémies virales augmente (dix en un siècle) et que leur succession est de plus en plus rapprochée (six depuis le début de ce siècle).
- Que toutes ont eu comme point de départ un virus d’origine animale sauvage ou domestique, peu ou pas connu.
- Que lorsque qu’un nouveau virus de cette nature émerge, anticiper quelle sera son évolution spontanée (mutation ? adaptation au nouvel hôte ? existence d’un réservoir animal ?) et celle de la maladie qu’il déclenche (mode de transmission ? gravité en termes de morbidité/mortalité ? contagiosité ? classes d’âge ciblées ? influence de la saisonnalité ? acquisition d’une immunité collective ?) relève du mirage.
Au plan de l’urgence sanitaire, il relève donc des gouvernements de mettre en place les mesures adaptées pour prévenir les risques infectieux graves susceptibles de se propager au-delà des frontières et de constituer une menace dans le monde entier et à y riposter : modalités qui figurent dans le Règlement Sanitaire International (OMS – 2005) (Lire Quel vocabulaire pour parler des épidémies).
Nous ne ferons que rappeler brièvement ces mesures que le Monde vient de vivre de façon inédite face à la crise sanitaire de la CoVid-19, et que les Etats ont mis en place à des degrés divers, surtout pour limiter l’impact économique de la pandémie [44].
Cet ensemble de mesures liées aussi à des « normes sociales » dont l’efficacité a été parfaitement démontrée dans des pays asiatiques qui avaient une expérience préalable d’épidémies due à des Coronavirus (Corée du Sud, Japon, Singapour, Taïwan, Hong-Kong…) et qui ont réussi à parfaitement contenir l’épidémie par leur mise en place très précoce. Que restera-t-il dans notre pays de ces nouveaux codes sociaux après la pandémie de CoVid-19 ? L’avenir nous le dira…
8. Messages à retenir
- La définition d’une pandémie repose principalement sur des critères géographiques. Elle recouvre plusieurs types d’événements et de menaces pour la santé publique, qui ont chacun leur propre gravité, leur fréquence et d’autres caractéristiques liées au virus et à l’infection qu’il déclenche.
- Chaque type d’événement nécessite une stratégie propre de préparation et d’optimisation de la réponse. L’immense diversité des menaces pandémiques est liée à celle des agents pathogènes et à leurs interactions avec l’Homme. Celles-ci varient selon plusieurs dimensions : mécanisme et dynamique de la transmission, gravité, morbidités associées. Tous ces facteurs déterminent si les cas initiaux seront identifiés et rapidement maîtrisés ou si l’éclosion va se propager.
- Les agents pathogènes ayant un potentiel pandémique ont des impacts très variables sur la santé, l’économie et la société. Les ressources, les capacités et les stratégies nécessaires pour enrayer l’expansion de l’agent causal sont aussi très variables selon les cas.
- La probabilité est grande que les effets du changement climatique décupleront les déséquilibres éco-systémiques, au risque d’engendrer des vagues de maladies vectorielles de niveau épidémique ou pandémique (Lire Changement climatique : quels effets sur notre santé ?).
Notes et références
[1] Noah Webster (1758-1843), considéré comme le père de l’épidémiologie aux Etats-Unis, accumulera une impressionnante littérature sur les épidémies et publiera en 1799 « A brief history of epidemic and pestilential diseases » (Hartford, printed by Hudson & Goodwin, published according to act of Congress) qui résume parfaitement tout ce que l’on peut lire alors sur les faits historiques et les théories sur les épidémies.
[2] Clemow F P329-331, February 10, Lancet 1894. The recent pandemic of influenza: its place of origin and mode of spread.
[3] Le développement des antibiotiques a permis de limiter les pandémies bactériennes (mais le problème de l’antibiorésistance fait que le combat n’est peut-être pas gagné) alors que l’on a plus de mal à traiter des maladies dues à des virus (vaccins antiviraux, trithérapie pour le SIDA…).
[4] Ce n’est que 80 ans après la pandémie que le virus responsable de la grippe espagnole a été séquencé à l’Institut de Pathologie des Forces Armées de Washington, à partir d’un fragment de poumon (formolé et inclus en paraffine) d’un jeune américain mort de l’épidémie en Caroline du Sud en septembre 1918. Des prélèvements réalisés sur la dépouille d’une jeune femme inuit de 18 ans ont permis de déterminer la séquence complète du génome du virus de la grippe espagnole.
[5] En Alaska, les taux de mortalité de certaines populations ont grimpé jusqu’à 85 %.
[6] On estime que les 5 400 espèces de mammifères existantes hébergent environ 460 000 espèces de virus, dont l’immense majorité reste à décrire. Seules 250 environ, dont le SARS CoV-2, ont acquis des stratégies moléculaires pour nous infecter, et une petite poignée peuvent donner des épidémies massives et des pandémies mortelles.
[7] Murphy F.A. 1998. “Emerging Zoonoses.” Emerging Infectious Diseases 4 (3): 429–35.
[8] Woolhouse M.E.J., Gowtage-Sequeria S. 2005. “Host Range and Emerging and Reemerging Pathogens.” Emerging Infectious Diseases 11 (12): 1842–47
[9] Van Boeckel T.P., Thanapongtharm W., Robinson T., Biradar C.M., Xiao X., et al. 2012. “Improving Risk Models for Avian Influenza: The Role of Intensive Poultry Farming and Flooded Land during the 2004 Thailand Epidemic.” PLoS One 7 (11): e49528.
[10] Wolfe N.D., Dunavan C.P, Diamond J. 2007. “Origins of Major Human Infectious Diseases.” Nature 447 (7142): 279–83.
[11] Pike B.L., Saylors K.E., Fair J.N., Lebreton M., Tamoufe U., et al. 2010. “The Origin and Prevention of Pandemics.” Clinical Infectious Diseases 50 (12): 1636–40.
[12] Par opposition au cycle urbain (où la transmission est strictement interhumaine), le cycle sylvatique, implique un réservoir animal, des primates non humains, et des vecteurs du genre Aedes, l’Homme n’étant alors qu’un hôte « accidentel ».
[13] Wolfe N.D., Daszak P., Kilpatrick A.M., Burke D.S. 2005. “Bushmeat Hunting, Deforestation, and Prediction of Zoonotic Disease.” Emerging Infectious Diseases 11 (12): 1822–27
[14] Biacchesi S., Chevalier C., Galloux M., Langevin C., Le Goffic R. & Brémont M. (2017) Les virus, Ennemis ou alliés ? Editions Quae
[15] Cleaveland, S., Laurenson, M. K., Taylor, L.H. (2001). Diseases of humans and their domestic mammals: pathogen characteristics, host range and the risk of emergence. Philosophical Transaction of the Royal Society London B 356, 991–999
[16] McNeil, W.H. (1976). Plagues and People. New York: Anchor Press
[17] Diamond, J. (1997). Guns, germs and steel: the fates of human societies. New York: Norton.
[18] Wolfe, N.D., Panosian Dunavan, C. & Diamond, J. (2007). Origins of major human infectious diseases. Nature 447, 279–83
[19] Davies, J.T. & Pedersen, A.B. (2008). Phylogeny and Geography Predict Pathogen Community Similarity in Wild Primates and Humans. Proceedings Biological Sciences. 275:1695-701
[20] Sharp P.M. & Hahn B.H. (2011). Origins of HIV and the AIDS Pandemic. Cold Spring Harb Perspect Med ;1:a 006841
[21] Bryant, J.E., Holmes, E.C. & Barrett, A.D.T. (2007) Out of Africa: a molecular perspective on the introduction of yellow fever virus into the Americas. PLoS Pathogens 3, e75.
[22] Le virus Zika, l’émergence d’une menace
[23] Ce pays sera aussi frappé dans la région de São Paulo -entre juillet 2017 et février 2018- par une épidémie de fièvre jaune.
[24] Johnson, N., Vos, A., Freuling, C., Tordo, N., Fooks, A.R. & Müller T. (2010). Human rabies due to lyssavirus infection of bat origin. J Vet Microbiol. 19, 142: 151-159.
[25] Rulli M.C. et al. (2017). The nexus between forest fragmentation in Africa and Ebola virus disease outbreaks. Sci. Reports volume 7, Article number: 41613.
[26] Giles J.R., Eby P., Parry H., Peel A.J., Plowright R.K., Westcot D.W. et al. (2018) Environmental drivers of spatiotemporal foraging intensity in fruit bats and implications for Hendra virus ecology. Scientific Report 8:9555.
[27] Ang B.S.P., Lim T.C.C. &Wang L. (2018) Nipah virus infection. J Clin Microbiol 56:e01875-17.
[28] Contre les pandémies, l’écologie, Sonia Shah
[29] Bean, A., Baker, M., Stewart, C. et al. (2013). Studying immunity to zoonotic diseases in the natural host — keeping it real. Nat Rev Immunol 13, 851–861 https://doi.org/10.1038/nri3551
[30] Zaki A.M., van Boheemen S., Bestirred T.M., Osterhaus A.D.M.E. & Fouchier R.A.M. (2012) Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med 367:1814–2.
[31] Zhu N, Zhang D, Wang W, Li X, Yang B, Song J et al. 2020. China Novel Coronavirus investigating and research team. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 382:727–33
[32] Les mammifères sauvages ne représentent plus aujourd’hui que 4 % de la biomasse des mammifères terrestres, les humains et leurs animaux domestiques représentant les 96 % restants.
[33] Morand S., McIntyre K.M. &Baylis M. (2014) Domesticated animals and human infectious diseases of zoonotic origins: domestication time matters. Infection Genetics Evolution 24: 76-87.
[34] Plus le temps depuis le début de domestication est long (ex. du chien ou de la vache), et plus le nombre d’agents pathogènes partagés avec les humains est élevé. Les animaux domestiques nous ont apporté les maladies infectieuses importantes, comme le bétail avec la rougeole, mais eux-mêmes constituent des ponts épidémiologiques essentiels entre la faune sauvage et les humains.
[35] Wells K., Morand S., Wardeh M., Baylis M. (2019) Distinct spread of DNA and RNA viruses among mammals amid prominent role of domestic species. Global Ecology and Biogeography https://doi.org/10.1111/geb.13045.
[36] https://wwwnc.cdc.gov/eid/article/21/12/15-0904_article
[37] La capacité des virus de grippe à muter et franchir les barrières entre espèces est connue depuis les années 1960. Mais c’est seulement depuis l’émergence du virus H5N1 en 1997 que de coûteuses mesures de précaution ont été imposées aux éleveurs par les autorités de santé à travers le monde. Depuis, des milliards de volailles ont été abattues, alors que le virus H5N1 a tué environ 500 personnes.
[38] « What you get when you mix chickens, China and climate change », The New York Times, 5 février 2016. En France, la grippe aviaire a touché les élevages durant l’hiver 2015-2016, et le ministère de l’agriculture a estimé qu’un risque existait pour les volatiles en provenance de Pologne. Une publication récente indique un dernier chiffre alarmant, plus de 2500 infections humaines de grippe aviaires hautement pathogènes ont été confirmées en laboratoire
[39] « Pour éviter les pandémies, cessons l’élevage industriel », Reporterre, 25 mai 2020.
[40] « L’épidémie de peste porcine continue de s’étendre : faut-il s’inquiéter? », Futura Planète, 1er novembre 2019.
[41] L’approche multisectorielle de l’OMS «Un monde, une santé», OMS, 2017.
[42] Predict Consortium, « One Health in action », EcoHealth Alliance, New York, octobre 2016
[43] « What we’ve found », One Health Institute.
[44] Au plan international : fermeture des frontières, quarantaine – transformée en « quatorzaine » – pour isoler temporairement les personnes non malades venant de pays ou zone d’épidémie. A l’échelle des États : fermeture des écoles, des universités et des lieux publics, dépistage des malades et des porteurs de virus et isolement des personnes infectées, confinement de la population pour préserver les personnes non atteintes, protections individuelles spécifiques des personnels de santé dans les hôpitaux, mises en place de mesures barrières destinées à prévenir la transmission interhumaine d’un virus respiratoire (port de masques, lavage des mains, distanciation sociale).
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : DROUET Emmanuel, GRILLOT Renée, MORAND Serge (5 juin 2023), Pandémies virales de l’ère moderne, Encyclopédie de l’Environnement. Consulté le 1 avril 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/pandemies-virales-ere-moderne/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







