Amazonie : un vaste écosystème en évolution permanente
PDF
La région amazonienne abrite la deuxième plus grande forêt de la planète après la forêt sibérienne, mais la première en termes de biodiversité. L’équateur la traverse ; le climat régional est qualifié de « chaud et humide ». Elle est soumise à un rythme saisonnier (saison sèche, saison humide), tel qu’elle reste toujours verte (sempervirente). Un immense réseau hydrographique l’irrigue, dont l’Amazone, le plus grand fleuve du monde. Objet singulier, complexe, au centre de multiples enjeux environnementaux, économiques et sociaux, du local au global, la recherche scientifique y consacre des efforts importants.[1] Néanmoins, notre ignorance à son sujet est encore grande. Cette forêt est aussi l’objet de récits plus ou moins fantasmés : « Eldorado », « Enfer Vert », « forêt d’émeraude », « poumon de la planète » ; elle aurait abrité des peuples isolés, des amérindiens redoutables, parfois cannibales, en fait souvent victimes et aujourd’hui perçus comme pacifiques et écologistes.Tout n’est pas faux, mais à relativiser grandement : qu’en savons-nous ? Quelles connaissances à acquérir et la façon de le faire ? Comment les utiliser et les compléter afin de décider et d’agir sur cet environnement ? À quel bénéfice ? Quel avenir pour les peuples qui l’habitent ?
On attribue à l’écosystème forestier amazonien un rôle planétaire de régulation des gaz à effet de serre (GES) et de réservoir de diversité biologique. Cet écosystème est aussi un objet économique, humain et social à travers les ressources qu’il recèle, les populations qui l’habitent et les attentions qu’il suscite. Réparti sur neuf pays, son avenir dépend de politiques diverses, y compris celles d’institutions non amazoniennes. Les changements bioclimatiques sont susceptibles de modifier son fonctionnement. Les actions humaines peuvent altérer sa structure : de la simple coupe de parcelles jusqu’à la déforestation de régions entières, ou, plus subtilement de modifications locales comme l’enrichissement en espèces « utiles ». Les représentations qu’on s’en fait, les idées qui en émergent, parfois loin des réalités de terrain, jouent un rôle déterminant, notamment dans les décisions politiques et techniques. Enfin, des processus biophysiques et écologiques spontanés le dotent d’une structure fortement aléatoire. C’est le cas, par exemple, de la dissémination des graines des végétaux, notamment des arbres, faite par les fluides, l’air et l’eau, dont les flux sont souvent turbulents, ou par les animaux (oiseaux, mammifères) dont les déplacements sont pour la plupart erratiques.
1. Forêt amazonienne : de quoi parle-t-on ?
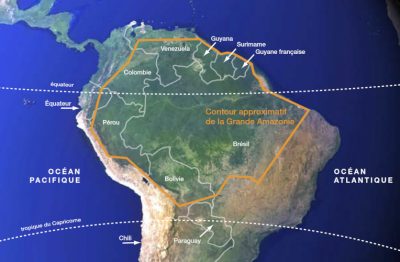
Au-delà de ces généralités, les données acquises sur cet écosystème montrent des variations non négligeables, dans l’espace et dans le temps. Ces variations sont souvent dues aux techniques et aux méthodes utilisées. À ces variations métrologiques, il faut ajouter la variabilité engendrée par les processus bioclimatiques et écologiques influençant la dynamique de l’écosystème. Les actions humaines comptent aussi beaucoup, assez douce et subtile dans le passé elles peuvent être brutales : abatages massifs suivis d’incendies volontaires.
1.1. Un vaste espace équatorial

La forêt est drainée par un vaste système hydrologique agissant sur la dynamique forestière et réciproquement. Le débit de l’Amazone à l’estuaire est évalué entre 200 000 à 250 000 m3/s, en moyenne sur l’année ; la quantité de sédiment arrivant dans l’océan est de l’ordre du milliard de tonnes par an, son bassin couvre une superficie de 6 790 000 km2. Des aires importantes sont épisodiquement inondées et constituent, de façon transitoire, de larges zones humides (Figure 3).

1.2. Un écosystème « enchevêtré »
Le terme enchevêtré (ou luxuriant) est l’une des traductions en français de « entangled » terme employé par Charles Darwin (Lire Focus Darwin) dans le dernier paragraphe de « L’origine des espèces », il semble adapté pour rendre compte de la complexité d’un écosystème amazonien, comme le suggère la photographie en entête de cet article.
Les caractéristiques globales du peuplement forestier sont de mieux en mieux connues : 16 000 espèces d’arbres, très mélangées, dont 227 sont dominantes, au total 390 milliards d’arbres [6],[7]. À titre de comparaison, au niveau planétaire, le nombre d’arbres est estimé à 3 040 milliards (près de 8 fois supérieures à une précédente évaluation de 400,25 milliards), dont 1 390 milliards dans les forêts tropicales et subtropicales, 740 milliards dans les forêts boréales, 610 milliards pour les forêts tempérées. 15 milliards seraient coupés chaque année et l’on pense que 46 % auraient disparus depuis le début des civilisations humaines [8]. On voit bien que les différences entre estimations au cours du temps ne sont pas négligeables, la plupart des discours à ce sujet ne prennent pas en compte ces incertitudes. Par ailleurs, la couverture arborée dépend grandement des conditions climatiques, elle change au cours du temps et est minimale durant les périodes glaciaires.
L’écosystème amazonien contient 10 à 13 % de la biodiversité continentale, pour 5% des terres émergées [9]. Il n’y a pas de recensement précis des espèces présentes en Amazonie. Celui concernant les arbres est particulier [10]. Toutes catégories confondues, on peut prendre comme points de repères quelques estimations collectées dans la littérature : de l’ordre de 2 millions d’espèces vivantes, incluant, par exemple, ~45 000 espèces végétales, ~1,3 millions d’espèces d’animales, dont ~1 million d’insectes, de l’ordre de 500 pour les mammifères, de 1 300 pour les oiseaux et de 3000 pour les poissons des fleuves. On est extrêmement loin d’avoir tout recensé et même tout simplement d’avoir des estimations fiables pour tous les groupes [11]. Aujourd’hui les recherches se focalisent plus sur l’étude des processus que sur les recensements et, maintenant, ces derniers ne sont faits que selon les besoins des études fonctionnelles.
1.3. Un rôle environnemental global

Néanmoins, les événements El Niño et La Niña, se produisant dans le pacifique, font ressentir leurs effets rapidement en Amazonie, au point que sur la période 2010-2017 le bilan est nul et pour ce qu’on a pu évaluer pour le passé, très variable [13]. Lors d’El Niño, des modifications du courant circumpolaire antarctique conduisent à une remontée des vents secs provenant de l’Antarctique. Ces mécanismes ont permis d’expliquer des événements du passé, par exemple les périodes sèches de l’Holocène (voir ci-après). De telles séquences sont épisodiques.
À l’échelle du jour, les échanges de GES varient, la respiration nocturne des végétaux, dégage du CO2, en revanche la photosynthèse diurne en absorbe. À l’échelle des saisons, le piégeage du CO2 est plus efficace en saison des pluies qu’en saison sèche.
Si le stock de carbone au-dessus du sol peut être a peu près estimé (voir ci-dessus), pour ce qui concerne les sols, on se heurte à des difficultés liées à la dimension du système amazonien, à la diversité pédologique, à celle du couvert végétal, aux usages notamment agricoles, mais aussi techniques et méthodologiques de mesure et d’exploitation des résultats. Un effort important a été fait ces dernières années avec la mise en place du REDD (Reducing Emissions from Deforestation and Forest Degradation in Developing Countries), ayant comme conséquence une évolution des exploitations agricoles et plus généralement de l’usage des terres.
Il serait audacieux de proposer des estimations au niveau de l’Amazonie et de sa forêt. Pour donner une idée de la variabilité des résultats, on peut citer le travail de Lucelma Aparecida Nascimento [14], qui donne les estimations variant entre 0 kg/m2 et 8,89 kg/m2 de carbone pour les sols forestiers (nord-ouest du Mato Grosso). Ce travail contient de nombreuses données et résultats d’analyse pour divers sols et couvertures végétales. Les effets de changement d’utilisation des terres sont en cours d’évaluation, les premiers résultats montrent que les sols des pâturages ont un stock de carbone organique supérieurs à celui des forêts. En revanche, on observe l’inverse pour les sols cultivés [15]. On note que ce type d’étude fait de plus en plus appel à la méta-analyse [16] en complément des travaux précis sur le terrain.
En tout état de cause, la forêt amazonienne joue un rôle important dans les grands bilans biogéochimiques. Le jour, comme toutes les forêts, elle absorbe du gaz carbonique, rejette de l’oxygène (grâce à la photosynthèse). La nuit, elle « respire » en utilisant de l’oxygène et relargue du CO2. Constamment, elle émet d’autres composés gazeux : NOx , COV, etc. Elle stocke du carbone surtout dans ses arbres et contribue au maintien d’un climat humide au niveau régional. Cependant, elle n’est en aucun cas le « poumon de la planète » ni le principal producteur d’oxygène, les autres forêts et les prairies y contribuent et surtout les océans. Comme nous allons le voir plus loin, elle est productrice de ressources renouvelables utilisables dont le bois (un moyen de stockage à long terme du carbone !). Les premiers concernés par le maintien, voire le développement, de cette production sont les habitants de cette forêt dont il convient de parler en premier, avant de s’agiter sur le « rôle global » (voir la section 3).
1.4. Histoire de l’Amazonie
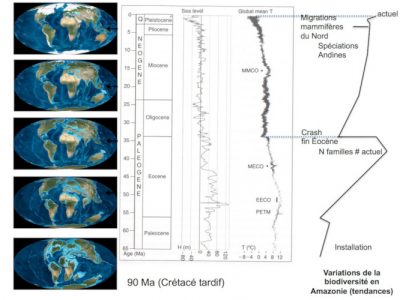
Lors de la dernière glaciation, la forêt amazonienne semble avoir bien résisté à la sécheresse. Au cours des 10 000 dernières années (Holocène), on enregistre des variations importantes du climat et du couvert forestier, ainsi entre 10 000 BP et 8 000 BP, entre 6 000 et 4 000 BP et plus récemment entre 1 500 et 1 100 BP puis entre 800 et 500 BP [20],[21],[22].
2. Structure et fonctionnement de la forêt amazonienne
Cette forêt se distingue d’autres cas déjà bien connus, comme celui des forêts françaises :
- régénération naturelle versus régénération principalement opérée par les humains ;
- zone bioclimatique (inter tropicale versus tempérée) ;
- grande biodiversité (un hectare de forêt guyanaise contient autant d’espèces autochtones d’arbres, en moyenne 200, que dans l’intégralité du territoire métropolitain : 137 pour 55 millions d’hectares) ;
- échelles très différentes (milliards versus, au plus, milliers d’hectares), etc.
Ce qui est présenté ci-après permet d’en savoir plus tout en sachant qu’on retrouve les grands mécanismes écologiques fondamentaux.
En-deçà de ces grands traits, il existe de multiples relations écologiques entre les êtres vivants, par exemple : la compétition entre les arbres (accès à la lumière et à la ressource hydrique), la prédation de la part d’animaux, la coopération, entre les arbres et les animaux pour la dissémination des graines, processus dit zoochore dominant en Amazonie, ou entre les arbres comme le partage de mycorhizes*, l’émission de COV peut signaler l’arrivée de prédateurs ou ravageurs (xylophages ou mangeurs de feuilles d’arbres) [28]. Tout cela nous rappelle que la forêt n’est pas qu’une collection d’arbres, mais un écosystème peuplé d’autres végétaux, d’animaux et de micro-organismes. Ces diverses entités sont en interaction.
La régénération spontanée est assez bien connue : après une perturbation correspondant à une destruction d’arbres, des arbres d’espèces héliophiles* s’installent. Puis, sous le couvert ainsi formé, une végétation plutôt ombrophile remplace progressivement les héliophiles. Le morceau de forêt se reconstitue, non pas à l’identique, mais de biodiversité proche de celle du peuplement avoisinant et précédent [29].
La forêt amazonienne a longtemps été considérée comme primaire* ou vierge, où les humains auraient joué un rôle négligeable, sinon nul, dans sa structure et son fonctionnement. En fait de nombreuses observations ont attiré l’attention des chercheurs, même en l’absence d’artefacts archéologiques, par exemple des enrichissements locaux en espèces « utiles » ou des transformations durables des sols. Les humains ont participé à la dynamique de cette forêt. Revisiter les notions mêmes de forêts primaires ou vierges est nécessaire suite à cette constatation.
3. Amazonie : un écosystème anthropisé


En fait, pour déclencher de véritables incendies il faut déforester de larges superficies, puis laisser sécher et brûler. Le plus souvent, le feu s’arrête à la lisière de la forêt, sinon la progression s’arrête rapidement tant l’humidité est grande. On craint cependant en cas de déboisement massif que le régime climatique auto-entretenu ne s’arrête et entraîne une réaction en chaîne d’assèchement et donc de sensibilité au feu.
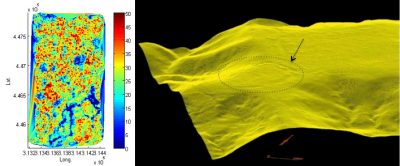
Parmi les résultats spectaculaires on peut citer les mécanismes écologiques spontanés de maintien de structures issues de l’agriculture amérindiennes mises en place il y a 800 ans dans les savanes côtières : les « champs surélevés » [35]. Ces structures ont persisté après le départ des habitants malgré les conditions drastiques de pluviométrie (Figure 10).

Les ressources vivantes amazoniennes sont nombreuses. Certaines ont été appropriées par les européens et largement valorisées ailleurs, par exemple, le cacao, l’ananas, le manioc, de nombreuses variétés de haricots [36], le cœur de palmier, etc. Il existe beaucoup de ressources ligneuses de haute qualité, peu exploitées qui pourraient l’être en utilisant des techniques modernes d’extraction « durables » de séchage et d’usinage. L’hévéa, producteur de latex, a connu un grand succès grâce aux plantations dans de nombreuses régions intertropicales. La gomme de balata a des propriétés mécaniques remarquables, elle est utilisée dans la fabrication des balles de golf « haut de gamme ». Parmi les médicaments, on peut citer la quinine, issue des quinquinas de la famille des rubiacées, trouvés sur le versant amazonien des Andes. Cependant, on constate le nombre restreint de produits pharmaceutiques issus de la forêt et des savoirs traditionnels pour lesquels on compte de l’ordre de 1 300 plantes à usage médicinal mais n’ayant pas donné lieu à de véritables développements. Le biopiratage à des fins pharmacologiques est plus un mythe qu’une réalité. Ce n’est probablement pas « l’or vert de l’Amazonie » [37] .

L’état de l’environnement est un facteur important à considérer pour améliorer la santé des populations amazoniennes, outre les pathogènes et leurs vecteurs, les pollutions peuvent l’altérer, comme celle par le mercure due à l’orpaillage [38]. On peut cependant souligner que la pollution de type physico-chimique peut être arrêtée en coupant la source. Elle reste au pire constante, sinon diminue progressivement. Ce n’est pas le cas pour les pathogènes qui se reproduisent et se répandent. Ils évoluent aussi rapidement et peuvent devenir résistants aux moyens de lutte, notamment aux antibiotiques. La biodiversité n’est pas bonne par essence et nous sommes loin d’avoir fait le tour : des plantes sont redoutablement toxiques, des animaux sont dangereux, etc.
Les ressources minérales, dont l’or, sont importantes. Leur exploitation sauvage perturbe l’environnement local, or l’essentiel de l’orpaillage est clandestin, de plus les conséquences sanitaires et sociales sont désastreuses. En revanche, certaines entreprises tentent de minimiser les dégâts et pratiquent une restauration après exploitation, c’est le cas présenté en Figure 11. Au Brésil, le cas les mines de Carajas (fer et manganèse) est spectaculaire, ainsi que celui de Serra do Navio en Amapá. Fort heureusement, la Renca (environ 41 000 km2 aux confins du Para et de l’Amapa), un temps menacée, reste pour l’instant protégée [39].
4. Faire évoluer l’approche écologique
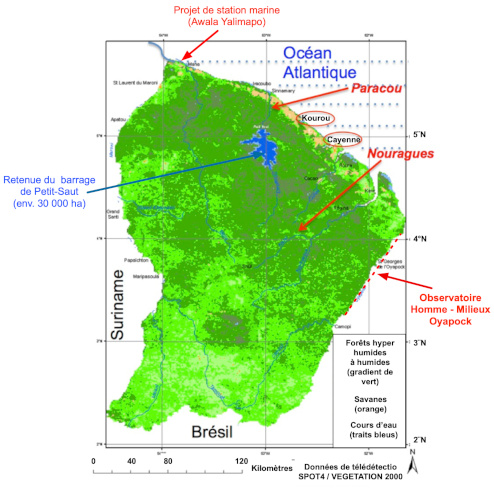
L’étude de la forêt amazonienne est passée du mode exploratoire à celui de l’écologie et de l’anthropologie. La première phase d’exploration et de récolte de données a été l’œuvre de naturalistes, de géologues, de géographes, d’anthropologues et d’ethnologues, dans un contexte colonial et néocolonial [40]. Puis des stations de terrain ont été implantées ; pour la Guyane, il s’agit, à partir des années 1980, de Paracou et des Nouragues (voir Figure 7) et d’autres de moindre importance. Simultanément, une révolution technologique a progressivement fait passer l’écologie de « l’écologie opinel, bouts de ficelle » à « l’écologie technologique » [41] (lire Focus Guyane et nouvelles technologies pour l’écologie). La recherche scientifique peut alors s’exprimer efficacement.
Les enjeux sont très importants, il nous faut gérer ces forêts avec divers objectifs, dont le maintien d’une grande biodiversité en préservant les intérêts des habitants. Cette intendance doit se fonder sur des connaissances de base solides et sur une approche multivariée et non pas sur une projection mono-dimensionelle, par exemple sur celle du strict facteur économique [42]. Un contexte idéal pour la conception d’une véritable ingénierie des systèmes écologiques.
4.1. Une forêt amazonienne en état instationnaire
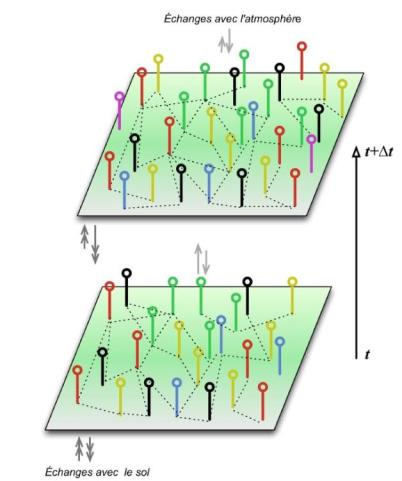
Ces interactions sont de natures différentes, entre arbres eux-mêmes ou mettant en cause d’autres êtres vivants, comme des animaux ou des micro-organismes, ou plus simplement des facteurs physiques ou chimiques (Figure 12).
La diversité, le nombre des objets impliqués et la non linéarité de leurs interactions mènent à qualifier un tel système de complexe. Y a-t-il des propriétés « émergentes » non réductibles à des bilans statistiques ? La question est ouverte.
4.2. Le hasard aux manettes
En tout état de cause, on peut quand même avancer que la stochasticité* et les réseaux d’interactions « souples et changeants » favorisent la résilience* de ces forêts. L’étude des processus engendrant de la variabilité et donc de la diversité devrait devenir une priorité, non seulement en écologie, mais plus généralement dans les sciences de la vie, en intégrant ainsi le débat de « l’écologie de l’ordre et du chaos » [43], lui-même étant une forme moderne de la controverse entre Parménide et Héraclite datant de… 2500 ans [44].
Il faut faire un effort théorique important pour avancer, par exemple sur la biodiversité, au risque que l‘érosion tant annoncée, ne soit d’abord celle du concept lui-même. C’est ce que craignent plusieurs auteurs [45], dont celui du présent article.
Enfin, la biologie a acquis l’essentiel de ses connaissances sur un nombre limité de modèles biologiques, en gros des organismes d’une cinquantaine d’espèces dont les célèbres drosophiles et Escherichia coli. Certains écosystèmes pourraient jouer ce rôle pour l’écologie et toute ou partie de la forêt amazonienne être l’un d’entre eux.
5. Messages à retenir

- Qu’en savons-nous ? Malgré un effort important de longue date, les données concernant l’Amazonie sont encore fragmentaires et imprécises. La forêt n’est pas qu’une collection d’arbres c’est un écosystème avec d’autres végétaux, des animaux, des microorganismes, irrigué par un vaste système hydrologique, avec de multiples interactions. Il faut se méfier des messages simplistes et des descriptions plus poétiques que scientifiques.
- Quelles connaissances à acquérir et la façon de le faire ? En complément de données factuelles, faire émerger une représentation synthétique, systémique de la région pour diriger l’acquisition des données environnementales qui demande aussi de poursuivre l’effort technologique. Ne pas hésiter à mener des réflexions théoriques.
- Comment les utiliser afin de décider et d’agir au mieux sur cet environnement ? Modéliser cet ensemble pour tester des scénarii d’évolution, promouvoir des stratégies adaptatives de ménagement, d’intendance, définir une véritable ingénierie des systèmes écologiques.
- À quel bénéfice ? Tout d’abord à celui des habitants de cette région, mais aussi à celui des nations qui l’abritent, sans oublier le rôle global de l’écosystème amazonien (climat et biodiversité), notamment de la forêt, concernant plus largement l’humanité.
- Quel avenir pour les peuples qui l’habitent ? (Figure 13) Cet avenir doit être « raisonné, choisi et partagé », en constante réévaluation et adaptation, en mettant en œuvre une gestion dynamique accompagnée par la modélisation et la simulation [46].
Notes et références
Image de couverture. [Source : CNRS Editions, Pavé A. et Fornet G voir réf. 3]
[1] La contribution française se fait principalement en Guyane, en relation avec des équipes d’autre pays, notamment brésiliennes.
[2] Au cours du temps, les sources d’erreur sont été identifiées et corrigées. C’est ce qui explique la variabilité des estimations, 5,5 millions de km2 est une estimation minimale. Rappel général : superficie du globe = 510 millions de km2 (510,067 420), océans = 362 millions km2 (361,8) et des terres émergées = 148 millions de km2 (148,2), superficie forestière (2010) = 4,033 milliards d’ha soit 40,033 millions de km2 (27% des terres émergées).
[3] Pavé A. & Fornet G., Amazonie, une aventure scientifique et humaine du CNRS, Ed. Galaade, Paris. 2010.
[4] Rayonnement dont les longueurs d’onde s’étendent de 400 à 700 nm, provoquant la photosynthèse chez les plantes. L’énergie lumineuse reçue par la surface éclairée s’exprime en µmol.m-2.s-1.
[5] U. Pöschl et al., Rainforest Aerosols as Biogenic Nuclei of Clouds and Precipitation in the Amazon. Science, 329, 2010, 1513-1516 ; Huisl W. & Pöschl U., The Amazon rainforest – a cloud factory. Max Planck Gesellschaft. 2010. https://www.mpg.de/622290/pressRelease20100920
[6] Stephen P. Hubbell et al. How many tree species are there in the Amazon and how many of them will go extinct? Proc. Nat. Acad. Sci. USA, 105, supp. 1, 2008.
[7] Hans ter Steege et al. Hyperdominance in the Amazonia Tree Flora. Science, 342, 2013.
[8] Crowther T. W. et al. Mapping tree density at a global scale, Nature, 525, 2015, 201–205.
[9] Lewinsohn T.M. & Prado P.I. How many species are there in Brazil? Conserv. Biology, 19, 2005, 619-624.
[10] En effet, les arbres restent en place. Ils sont de grande taille. Ils ont une durée de vie longue. Leur observation est plus aisée que celle d’organismes mobiles et plus petits, comme les animaux. Cependant, les arbres se déplacent, mais le mouvement est intergénérationnel : dissémination des graines, puis succès ou non de la germination et de la croissance selon les conditions bioécologiques locales. C’est ainsi que les populations d’arbres peuvent migrer lors de variations bioclimatiques.
[11] De fait, on découvre régulièrement de nouvelles espèces en Amazonie. Dans un rapport du WWF publié le 30 août 2017, il était fait mention de 381 nouvelles espèces identifiées, hors insectes.
[12] Fernando D.B., Espírito-Santo et al. Size and frequency of natural forest disturbances and the Amazon forest carbon balance. Nature Communications volume 5, Article number: 3434, 2014
[13] Lie Fan et al. Satellite-observed pantropical carbon dynamics. Nature Plants, 07/29/2019. et La biomasse aérienne de la végétation de la zone tropicale n’a plus d’impact positif sur le stockage du carbone.
[14] Nascimento L.A. Stockage du carbone dans les sols et dynamique des paysages en Amazonie : l’exemple du Nord-Ouest de l’État de Mato Grosso – Brésil dans le cadre du REDD (Réduction des Émissions par Déforestation et Dégradation). Géographie. Université Rennes 2, 2015. Français. https://www.theses.fr/2015REN20028
[15] Fujisaki K., Perrin A. S., Desjardins T., Bernoux M., Balbino L.C. & Brossard M. (2015). From forest to cropland and pasture systems: a critical review of soil organic carbon stocks changes in Amazonia. Global Change Biology, 21 (7), 2773-2786. ISSN 1354-1013
[16] Pour plus de précision sur la méta-analyse, on pourra consulter : Makowski D., Synthétiser les connaissances en agronomie. Notes Académiques de l’Académie d’agriculture de France, 2017. https://www.academie-agriculture.fr/publications/notes-academiques/n3af-2017-3-note-de-synthese-synthetiser-les-connaissances-en
[17] On utilise les abréviations anglo-saxonnes : BP (Before Present), BC (Before Christ), AC (After Christ).
[18] Hoorn C. & Wesselingh F (Eds). Amazonia Lanscape and Evolution. A look into the past. Whiley-Blackwell, Oxford, UK, 2010.
[19] Randford T., Could humans cause another Paleocene-Eocene Thermal Maximum? Climate Homenews, 2013.
[20] Schwarz D. Expansions et recul des forêts équatoriales. Pour La Science, 271, 2000.
Dans cet article, on trouve l’essentiel des résultats présentés dans les deux références suivantes et obtenus principalement par le programme ECOFIT « Écosystèmes Forestiers Inter Tropicaux », une initiative IRD/CNRS (Programme Environnement), soutenue par l’UNESCO.
[21] Poncy O., Sabatier D., Prévost M.F. & Hardy I. The lowland high rainforest structure and tree species diversity, in Bongers F., Charles-Dominique P., Forget P.M. & Théry M. (Eds) « Nouragues. Dynamics and Plant-Animal Interactions in a Neotropical Rainforest », Kluwer Acad. Publish. 2001, 32-46.
[22] Servant M & Servant-Vildary S. (Eds, 2000). Dynamiques à long terme des écosystèmes forestiers intertropicaux CNRS, UNESCO, MAE, IRD, Paris, 427p.
[23] Pavé A. Necessity of chance: biological roulettes and biodiversity, C.R. Biologies, 330, 2007, pp. 189-198
[24] La superficie du territoire guyanais est de 84 000 km2 (voisine de celle du Portugal) dont 75 000 km2 de forêt (de l’ordre de 50% des forêts métropolitaines).
[25] Gourlé-Fleury S., Guehl J.M. & Laroussinie O. Ecology and Management of a Neotropical Forest. Lessons drawn from Paracou, a long-term experimental research site in French Guiana. Elsevier, 311p, 2004.
[26] Saint-Jean D. & Pellet E. Explorateurs d’Amazonie. Aventuriers de la Science en Guyane. Ibis Rouge Éditions, 2008 (Préface Alain Pavé).
[27] http://www.guyane.cnrs.fr/
[28] Il faut être très prudent dans l’utilisation des mots, au départ ayant une signification anthropique : il n’y a aucune intention derrière la compétition et la coopération dans les systèmes écologiques. Ces mécanismes s’installent spontanément.
[29] Norten N., Angarita H. A., Bongers F., Martinez-Ramos M., Granzow-de la Cerda I., van Breugel M., Lebrija-Tejos E., Meave J.A., Vandermeer J., Bruce Williamson G., Finegan B., Mesquita R. & Chazdon R.L. Successional dynamics in neotropical forests are as uncertain as they are predictable. Proc. Nat. Acad. Sci. USA, 112, 8013-8018, 2015.
[30] Anna Roosevelt est l’une des archéologues et écologues les plus connues travaillant sur l’Amazonie. Elle prolonge un intérêt familial pour cette région issu de son arrière-grand père Théodore Roosevelt, qui fut président des Etats-Unis (1901-1909) et séjourna de nombreuses fois en Amazonie après ses deux mandats. Parmi les nombreuses publications de Anna Roosevelt on peut retenir : Roosevelt A.. Twelve Thousand Years of Human-Environment Interaction in the Amazon Floodplain. Advances in Economic Botany, Vol. 13. New York Botanical Garden. pp. 371–392, 1999. Elle a été membre du Comité scientifique du Programme Amazonie du CNRS.
[31] Reich D. et al. Reconstructing Native American population history. Nature, 488, 370-375, 2012. Ces travaux ont été soutenus par le Programme Amazonie du CNRS.
[32] Rostain S., Amazonie : les 12 travaux des civilisations précolombiennes. Belin, Paris, 2017 ; & Rostain S., Amazonie un jardin sauvage ou une force domestiquée. Essai d’écologie historique. Actes Sud, errance, 2011.
[33] Molino J.F., Mestre M. & Odonne G. La biodiversité de l’Amazonie, un héritage des Précolombiens ? La Recherche, 527, 67-71, 2017.
[34] Jérémie S. & Dambrine E. Impact des occupations amérindiennes anciennes sur les propriétés des sols et la diversité des forêts guyanaises. In, Pavé A. & Fornet G., Op. Cit. ref [3].
[35] McKey D., Rostain S., Iriarte J., Glaser B., Birk J.J., Holst I. & Renard D., « Pre-Columbian Agricultural Landscapes, Ecosystem Engineers, and Self-organized Patchiness in Amazonia », Proc. Nat. Acad. Sci. USA, 107, 2010, p. 7823-7828. Communiqué de presse CNRS, 13 mars 2010.
[36] Le Centre international de recherche agronomique tropicale de Cali en Colombie maintient une collection vivante de l’ordre de 5000 variétés. Ces collections constituent l’un des moyens de maintenir la biodiversité.
[37] En 1997, lors d’une émission télévisée, j’étais beaucoup plus optimiste, 20 ans après ayant augmenté mon expérience amazonienne je suis beaucoup plus réservé… On peut trouver cet extrait dans la page WEB : http://www.cnrs.fr/cw/dossiers/dosbiodiv/index.php?pid=decouv_chapC_p3
[38] http://www.epoc.u-bordeaux.fr/index.php?lang=fr&page=eq_ea_flash01 et le document synthétique : https://hist-geographie.dis.ac-guyane.fr/…/2d1_les_defis_de_la_sante_en_guyane.doc
[39] La Renca (Reserva Nacional do Cobre e Associados) a été créée au début des années 1980 en vue d’une exploitation minière future. En l’absence de cette exploitation elle est devenue de fait une réserve naturelle. Ce statut a été menacé en 2017 par le président du Brésil de l’époque, Michel Temer. Devant la protestation nationale et internationale, le statut a été maintenu.
[40] Raby M., The Colonial Origin of Tropical Field Station. Am. Scientist, 105, 216-223, 2017.
[41] Legay J.M. & Barbault R. (Dir.). La révolution technologique en écologie. Masson, 1995.
[42] Pavé A., Comprendre la biodiversité, vrais problèmes et idées fausses. Édition du Seuil, 2019
[43] Worster D. The Wealth of Nature, Environmental History and the Ecological Imagination. Oxford University Press, 1993.
[44] Ces deux philosophes présocratiques vivaient bien à la même époque, mais étaient très éloignés l’un de l’autre. Élée, au sud de l’actuelle Italie, pour Parménide, et Éphèse, côte ouest de la présente Turquie, pour Héraclite. Ce débat, sans doute virtuel, a été reconstitué à partir d’écrits de ces deux philosophes et de ceux qui s’en inspirèrent. Schématiquement et en termes actuels, Parménide défendait l’idée d’un monde stationnaire, les mouvements et changements observés répondant à des mécaniques permanentes. Héraclite avait une conception d’un monde en constante évolution (« on ne se baigne jamais deux fois dans le même fleuve »), avec des dynamiques souvent chaotiques. Ce débat a marqué implicitement l’histoire des idées, il est même encore très présent, notamment en écologie (voir, la référence précédente).
[45] Casseta E. & Delors J. (Eds). La biodiversité en question. Enjeux philosophiques, éthiques et scientifiques. Éditions Matériologiques, 2014, Paris.
[46] La technologie multi-agents a déjà fait la preuve de son efficacité, notamment pour modéliser des socio-écosystèmes. Le concept de modélisation d’accompagnement semble bien adapté à ce type de situation. Réf. : Collectif Comod, La modélisation comme outil d’accompagnement, Natures Sciences Sociétés, 13, 165-168, 2005. Il n’est pas hors de propos de s’inspirer aussi des travaux des automaticiens, curieusement peu connus en dehors du domaine de l’ingénierie industrielle. Dans les années 1980, en Rhône-Alpes, la coopération initiée entre biométriciens de Lyon et automaticiens de Grenoble, amplifiée au sein du club Edora de l’Inria, a été très efficace, notamment dans l’établissement de cette coopération.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : PAVE Alain (21 juin 2022), Amazonie : un vaste écosystème en évolution permanente, Encyclopédie de l’Environnement. Consulté le 31 mars 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/amazonie-ecosysteme-evolution-permanente/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







