Changement climatique et mondialisation, moteurs des invasions d’insectes
PDF
Le réchauffement climatique et la mondialisation des échanges commerciaux ont un impact déterminant sur la distribution géographique des insectes. On observe une explosion de l’établissement d’insectes non-indigènes à l’échelle mondiale, avec l’expansion des réseaux commerciaux. Dans le même temps, le réchauffement climatique favorise l’expansion vers le Nord et en altitude de nombreuses espèces d’insectes. Ces deux facteurs combinés expliquent les multiples invasions d’insectes observées ces dernières années.
- 1. Une explosion de l’établissement d’insectes exotiques en Europe
- 2. Les espèces exotiques diffusent de plus en plus vite à travers l’Europe
- 3. Le réchauffement climatique modifie l’aire de distribution des insectes
- 4. L’augmentation annuelle de la température moyenne, une variable pertinente ?
- 5. Expansion vers le Nord et contraction au Sud ?
- 6. Mondialisation et réchauffement climatique agissent de manière combinée
- 7. Le réchauffement seul en cause dans l’expansion des insectes ?
- 8. Messages à retenir
1. Une explosion de l’établissement d’insectes exotiques en Europe
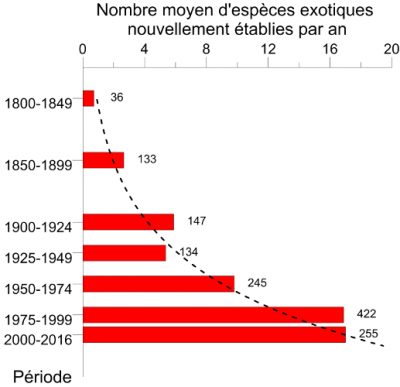
Si la destruction des habitats naturels est la première cause du déclin actuel de la biodiversité, les invasions d’espèces exotiques arrivent en seconde position. Le taux d’établissement d’espèces d’insectes exotiques, c’est-à-dire introduites sur un continent autre que celui d’origine, a augmenté exponentiellement depuis le début du 20e siècle. Ainsi, en Europe on est passé de 9,7 espèces nouvellement établies par an durant la période 1950-1974 à 17,0 durant la période 1990-2016 [1] (Figure 1). Fin 2016, 1418 espèces d’insectes exotiques avaient été identifiées comme introduites et établies en Europe [2], constituant ainsi le 2e groupe d’espèces exotiques après les plantes [3] (lire Quand les plantes envahissantes se promènent aussi dans les champs). Des valeurs similaires sont observées sur d’autres continents [4].

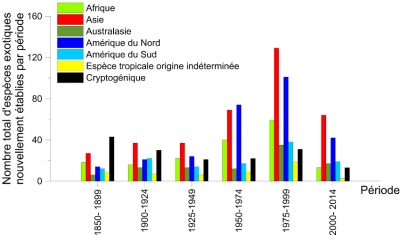
Désormais, les espèces qualifiées d’« émergentes » (car n’ayant jamais été précédemment introduites dans un continent autre que celui d’origine [6]) sont devenues prédominantes. C’est le cas, par exemple, du frelon asiatique détecté en France en 2004.
2. Les espèces exotiques diffusent de plus en plus vite à travers l’Europe
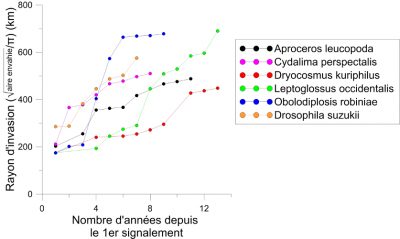
On observe une accélération de la vitesse d’expansion des insectes exotiques. Les espèces exotiques s’étant établies en Europe durant les deux dernières décennies ont une vitesse moyenne d’expansion plus rapide que celles qui sont arrivées juste après la 2de guerre mondiale [1]. Nombre d’entre elles ont colonisé la quasi-totalité du continent en moins d’une quinzaine d’années alors que la majorité des espèces établies durant la première moitié du 20e siècle ont mis plusieurs dizaines d’années pour y parvenir. Plusieurs exemples indiquent que cette vitesse d’expansion est indépendante de l’origine de l’insecte introduit (Figures 4 et 5).

Des insectes d’origine asiatique ont connu des propagations encore plus fulgurantes, colonisant la majeure partie de l’Europe en moins de 10 ans :
- Le papillon pyrale du buis, Cydalima perspectalis (Figure 4), détecté pour la première fois en 2006 en Allemagne [8];
- la mouche des fruits, Drosophila suzukii (Figure 4), détectée en 2008 en Italie [9];
- Un papillon d’origine sud-américaine, la mineuse de la tomate, Tuta absoluta (Figure 4), observé pour la première fois en 2006 en Espagne [10].
- 4 fois supérieure à celle des espèces établies juste après la seconde guerre mondiale (1950–1969),
- 3 fois supérieure à celle des espèces détectées durant la période 1970- 1989 [1].
Cette accélération récente de l’expansion des insectes exotiques (Figure 5) pourrait être liée aux changements politico-économiques survenus en Europe (chute du mur de Berlin et élargissement de l’Union Européenne), avec en particulier la suppression des contrôles douaniers intra-communautaires [1].
- La pyrale du buis (Cydalima perspectalis) et la punaise nord-américaine des graines (Leptoglossus occidentalis) ont progressé sur un an d’un rayon de plus de 150 km (Figures 4 et 5) alors que la capacité de vol des adultes a été estimée à quelques dizaines de kilomètres [8].
- Un tout petit moucheron (taille adulte : 5 mm) d’origine nord-américaine, la cécidomyie du robinier (Obolodiplosis robiniae) a progressé en 2 ans d’un rayon de plus de 450 km (Figures 5 et 6) [1].

3. Le réchauffement climatique modifie l’aire de distribution des insectes
Avec une augmentation de la température moyenne du globe de 0,61°C depuis le début du 20e siècle et un réchauffement futur estimé entre 2,6 et 4,8°C pour 2100 selon les modèles du Groupement d’experts inter-gouvernemental sur l’évolution du climat (GIEC [12]), on peut s’attendre à un impact important du changement climatique sur la majorité des espèces d’insectes. Cet impact prévisible est lié à la biologie même des insectes.
En effet, les insectes sont des animaux à sang « froid » qui ne produisent pas de chaleur. On les qualifie ainsi d’« ectothermes » contrairement aux mammifères « endothermes » qui sont capables de produire de la chaleur grâce à leur activité métabolique et de garder leur température corporelle à peu près constante. La température corporelle des insectes et les processus physiologiques associés vont donc dépendre directement des variations de la température ambiante. Ces variations vont, entre autres, gouverner leurs périodes et rythmes d’activité, la durée de leurs différents stades de développement larvaire et le nombre de générations annuelles, leurs possibilités d’envol, etc…. Pour de très nombreuses espèces, des seuils spécifiques de température délimitent des barrières bornant leur aire géographique de distribution :
- Ainsi, l’isotherme -16°C limite les possibilités de survie hivernale d’un coléoptère nord-américain, important ravageur des conifères, Dendroctonus frontalis [13] (Figure 8), comme celles des chenilles de processionnaires du pin (voir Focus).
- Mais l’isotherme +40° limite aussi la survie estivale des œufs de cette même processionnaire [14].

- En Europe, 63% des papillons non migrateurs ont vu leur aire de répartition progresser vers le Nord sur des distances de 35 à 240 km au cours du siècle dernier, en concordance avec le déplacement moyen des isothermes de 120 km vers le pôle dû à un réchauffement d’environ 0,8°C [15].
- Dans l’Ouest de l’Amérique du Nord, l’expansion moyenne vers le Nord de 92 km du papillon Euphydryas editha a été également reliée à un déplacement septentrional des isothermes de 105 km durant la même période [16].
- Des phénomènes similaires d’expansion vers le Nord et à des altitudes plus élevées de coléoptères, de libellules et de sauterelles ont été observés au cours des 30 dernières années [17].
Cependant, la simple comparaison de la distribution passée et actuelle des espèces avec le déplacement des isothermes durant la même période ne suffit pas pour prouver l’implication du changement climatique. Pour démontrer que cela ne peut pas résulter d’une simple corrélation, il est indispensable de dégager un lien causal entre modification de l’aire de répartition et variation du facteur climatique considéré.

- Jusqu’au début des années 2000, la survie hivernale du scolyte Dendroctone du pin (Dendroctonus frontalis– Figure 8) n’était possible que dans le sud-est des États-Unis, en raison de sa température létale hivernale estimée à -16 °C. Cette zone constituait alors la limite nord de l’aire de distribution de l’insecte. Le déplacement latitudinal vers le nord de l’isotherme -16°C a permis à l’insecte de coloniser des zones à des latitudes nettement plus septentrionales du nord-est des États-Unis [18].
- La survie hivernale des œufs de plusieurs espèces de papillons géométrides est également favorisée dans des zones du nord de la Scandinavie jusque-là impropres à leur établissement 18 (Figure 9).
- Des relations de cause à effet ont été expérimentalement établies quant au rôle du réchauffement hivernal dans l’expansion de la processionnaire du pin [voir Focus]. [19]
4. L’augmentation annuelle de la température moyenne, une variable pertinente ?
Le réchauffement climatique est le plus souvent apprécié à partir de l’augmentation de la température moyenne annuelle de l’air au niveau de la mer. Cependant, les populations d’insectes ne sont pas confrontées à une température moyenne, mais à une variation quotidienne des conditions météorologiques dans lesquelles elles se développent. La seule prise en compte de l’augmentation de la température annuelle peut masquer des effets différenciés des réchauffements saisonniers.
Ainsi, une augmentation de la température en hiver, au printemps, en été, ou en automne n’aura pas le même impact biologique pour permettre ou non l’expansion des populations. Si l’augmentation des températures hivernales permet à certaines espèces de survivre dans des zones préalablement défavorables, une augmentation des températures printanières et/ou estivales va tendre à accélérer le développement des stades immatures, permettant une augmentation du nombre de générations annuelles chez certaines espèces, et à favoriser les déplacements.
- C’est en particulier le cas pour les espèces migratrices de papillons comme la noctuelle Autographa gamma dont les incursions en Grande-Bretagne à partir des sites d’hivernation en Afrique du Nord sont facilitées par l’élévation des températures [20].
- Dans les Alpes italiennes, la vague de chaleur estivale de 2003 a aussi permis à la processionnaire du pin d’étendre sa distribution car les nuits où la température dépassait le seuil requis pour l’envol des femelles (14°C) étaient alors 5 fois plus fréquentes que la normale, permettant à une plus grande proportion de papillons de se disperser sur de longues distances [21].

5. Expansion vers le Nord et contraction au Sud ?
Peu de données existent sur la possible contraction de l’aire de distribution à sa limite sud avec la hausse des températures. Chez la plupart des papillons de jour européens, la limite méridionale des espèces progressant vers le nord semble être restée stable, et seules quelques- unes comme le papillon lycène Heodes tytirus, montrent un déclin des populations au sud de l’aire [15]. Pour deux espèces de papillons de nuit (Lymantria dispar et L. monacha), des simulations basées sur l’augmentation prévisible des températures dans le futur suggèrent une rétraction de la limite sud de 100 à 900 km en raison des effets négatifs de températures trop élevées sur la sortie des œufs de leur diapause hivernale [22], phénomène qui correspond à un arrêt temporaire du développement en réponse à l’apparition de conditions climatiques défavorables, ici les températures hivernales.
Plus globalement, pour les insectes se développant durant le printemps et l’été, les changements dans l’aire de répartition pourraient être grossièrement déterminés par une combinaison entre vitesse de développement (rapide ou lente) et processus de diapause hivernale [23] :
- les espèces à développement rapide, sans diapause, auront tendance à augmenter le nombre de générations par an et à augmenter leur aire de distribution (cas d’espèces de pucerons) ;
- les espèces à développement rapide, mais avec une diapause affectée par la température, auront tendance à voir leur aire se rétracter (cas des papillons paon de jour, Inachis io, ou petit paon de nuit, Saturnia pavonia);
- les espèces à développement lent et avec une diapause affectée par la température, auront tendance à décliner et à voir leur aire réduite (cas du Bombyx du chêne, Lasiocampa quercus).
6. Mondialisation et réchauffement climatique agissent de manière combinée
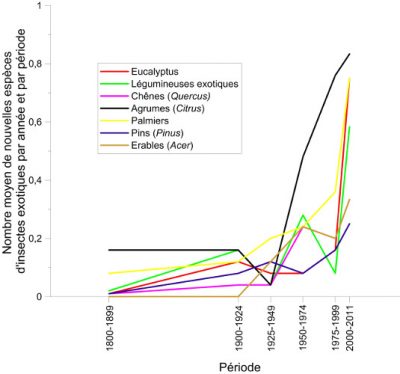

7. Le réchauffement seul en cause dans l’expansion des insectes ?
La plupart des études se sont jusqu’à présent essentiellement intéressées aux effets induits par la hausse des températures. Mais le changement climatique intègre de multiples autres facteurs, comme l’humidité, l’intensité et la périodicité des précipitations, le rayonnement, ou le niveau des gaz à effet de serre, qui peuvent agir directement ou en synergie avec la hausse des températures. Par exemple, l’établissement dans nos régions du moustique-tigre exotique, Aedes albopictus, est conditionné par la température mais aussi par la durée du jour en regard de celle de la nuit (photopériode), l’humidité et la pluviométrie [28]. Mais les autres études, le plus souvent menées en conditions de laboratoire, ne donnent pour l’instant que des indications souvent contradictoires quant aux réponses possibles des insectes aux fluctuations de ces variables, par exemple sur l’effet du CO2 [29]. Le développement d’expériences de terrain à grande échelle apparait indispensable.
Les travaux sur les relations entre changement climatique et expansion des insectes ont souvent ciblé les réponses spécifiques d’insectes à fort impact économique ou sanitaire, en prenant rarement en compte les organismes qui leur sont associés. Or, le changement climatique affecte de manière simultanée l’ensemble de l’écosystème, incluant les (plantes) hôtes, les insectes compétiteurs et les ennemis naturels. Les réponses de chacune de ces composantes peuvent différer pour une même hausse de température et les interactions s’en trouver largement modifiées, dans un sens ou un autre. Ainsi, des études suggèrent que l’efficacité de certains prédateurs, tels que les coccinelles, pourrait augmenter dans un environnement plus chaud, et l’expansion des pucerons-proies s’en trouver freinée [30]. A l’inverse, la processionnaire du pin progresse plus vite vers le nord que ses ennemis naturels [31]. Le développement d’études intégrées, considérant simultanément toutes les composantes des écosystèmes, est une nécessité pour les recherches futures.
8. Messages à retenir
- L’intensification et la diversification des échanges commerciaux mondiaux, notamment des plantes ornementales, conduit à l’augmentation de l’établissement d’insectes exotiques en Europe.
- Après leur établissement, ces insectes exotiques tendent à se propager à travers l’Europe plus vite qu’au siècle dernier.
- Le réchauffement, en particulier celui des températures hivernales, lève les barrières climatiques limitant l’aire d’un certain nombre d’espèces indigènes ou exotiques, et permet leur expansion dans des zones précédemment défavorables à leur survie durant l’hiver.
- Le réchauffement facilite l’établissement et la propagation d’espèces exotiques d’origine subtropicale et tropicale.
Notes et références
Image de couverture. Attaque massive de la processionnaire du pin au niveau de son front altitudinal d’expansion dans les Alpes Italiennes. Oulx, Piémont ; hiver 2015-2016. [Source : Roques, INRA©].
[1] Roques A., Auger-Rozenberg M.-A., Blackburn T.M., Garnas J.R., Pyšek P. et al. (2016) Temporal and interspecific variation in rates of spread for insect species invading Europe during the last 200 years. Biological Invasions 18, 907-920.
[2] Source : base de données du projet Européen DAISIE (« Delivering Alien Invasive Species Inventories in Europe » ; http://www.europe-aliens.org) récemment mise à jour dans la base de données EASIN (« European Alien Species Information Network »; http://easin.jrc.ec.europa),
[3] DAISIE (2009) Handbook of alien species in Europe. Berlin: Springer Science + Business Media B.V.
[4] Seebens H., Blackburn T.M., Dyer E.E., Genovesi P., Hulme P.E. et al. (2017) No saturation in the accumulation of alien species worldwide. Nature Communications. DOI: 10.1038/ncomms14435.
[5] Roques A., Rasplus J.Y., Rabistch W., Lopez-Vaamonde C., Kenis M et al. (2010). Alien Terrestrial Arthropods of Europe. BioRisk 4 (1 et 2), 1-1024.
[6] Seebens A., Blackburn T.M., Dyer E.E., Genovesi P., Hulme P.E. et al. (2018). The global rise in emerging alien species results from increased accessibility of new source pools. Proceedings of the National Academy of Sciences of the USA. doi/10.1073/pnas.1719429115.
[7] Lesieur V., Lombaert E., Guillemaud T., Courtial B., Strong W. et al. (2018) The rapid spread of Leptoglossus occidentalis in Europe: a bridgehead Invasion. Journal of Pest Science. https://doi.org/10.1007/s10340-018-0993-x
[8] Bras A. Invasion fulgurante de la pyrale du buis en Europe: Caractérisation de la diversité génétique de Cydalima perspectalis (Walker, 1859) et approche phylogéographique https://belinra.inra.fr/doc_num.php?explnum_id=1021
[9] Cini A., Ioriatti C., Anfora G. (2012). A review of the invasion of Drosophila suzukii in Europe and a draft research agenda for integrated pest management. Bulletin of Insectology 65(1) 149-160.
[10] Desneux N., Luna M.G., Guillemaud T. et Urbaneja A. (2011) The invasive South American tomato pinworm, Tuta absoluta , continues to spread in Afro-Eurasia and beyond the new threat to tomato world production. Journal of Pest Science 84, 403 – 408.
[11] Javal M., Roques A., Haran J., Herard F., Keena M., Roux G. (2017) Complex invasion history of the Asian long-horned beetle: fifteen years after first detection in Europe. Journal of Pest Science DOI 10.1007/s10340-017-0917-1.
[12] http://ar5-syr.ipcc.ch/
[13] Ungerer M.J., Ayres M.P., Lombardero M.J. (1999). Climate and the northern distribution limits of Dendroctonus frontalis Zimmermann (Coleoptera: Scolytidae). Journal of Biogeography 26, 1133–45.
[14] Robinet C., Rousselet J., Pineau P; Miard F., Roques A. (2013). Are heat waves susceptible to mitigate the expansion of a species progressing with global warming? Ecology and Evolution 3(9), 2947-57.
[15] Parmesan C, Ryrholm N, Stefanescu C et al. (1999). Poleward shifts in geographical ranges of butterfly species associated with regional warming. Nature 399, 579–83.
[16] Parmesan C (1996). Climate change and species’ range. Nature 382, 765-766.
[17] Hickling R., Roy D.B., Hill J.K., Fox R., Thomas C.D. (2006). The distributions of a wide range of taxonomic groups are expanding polewards. Global Change Biology 12, 450- 455.
[18] Trân J.K., Ylioja T., Billings R.F., Régnière J., Ayres M.P. (2007). Impact of minimum winter temperatures on the population dynamics of Dendroctonus frontalis. Ecological Applications 17, 882-899.
[19] Jepsen J.U., Hagen S.B., Ims R.A., Yoccoz N.G. (2008). Climate change and outbreaks of the geometrids Operophtera brumata and Epirrita autumnata in subarctic birch forest: evidence of a recent outbreak range expansion. Journal of Animal Ecology 77, 257-264.
[20] Chapman J.W., Reynolds D.R., Smith A.D., Riley J.R., Pedgley D.E., Woiwod I.P. (2008). Wind selection and drift compensation optimize migratory pathways in a high-flying moth. Current Biology 18, 514-518.
[21] Battisti A. Stastny M., Buffo E., Larsson S. (2006). A rapid altitudinal range expansion in the pine processionary moth produced by the 2003 climatic anomaly. Global Change Biology 12, 66- 671.
[22] Vanhanen H., Veteli T.O., Pailvinen S., Kellomaki S., Niemala P. (2007). Climate change and range shifts in two insect defoliators: Gypsy moth and nun moth – A model study. Silva Fennica 41, 621–38 ;
[23] Bale J.S., Masters G.J., Hodkinson I.D. et al. (2002). Herbivory in global climate change research: Direct effects of rising temperature on insect herbivores. Global Change Biology 8, 1–16.
[24] Eschen R., Roques A., Santini, A. (2015). Taxonomic dissimilarity in patterns of interception and establishment of alien arthropods, nematodes and pathogens affecting woody plants in Europe. Diversity and Distributions 21 (1), 36-45.
[25] Walther G R., Roques A., Hulme P.E., Sykes M.T., Pyšek P., et al. (2009). Alien species in a warmer world: risks and opportunities. Trends in Ecology and Evolution 24, 686- 692.
[26] Roques A. (2010). Alien forest insects in a warmer world and a globalized economy: Impacts of changes in trade, tourism and climate on forest biosecurity. New Zealand Journal of Forestry 40, 77-94.
[27] Ott J., ed (2008). Monitoring climate change with dragonflies. Series Faunistica 81. Pensoft, Sofia. Cannon R.J.C. (1998). The implications of predicted climate change in the UK, with emphasis on non-indigenous species. Global Change Biology 4, 785- 796.
[28] Eritja R., Escosa R., Lucientes J. et al. (2005). Worldwide invasion of vector mosquitoes: Present European distribution and challenges for Spain. Biological Invasions 7, 87–97.
[29] Newman J.A. (2005). Climate change and the fate of cereal aphids in Southern Britain. Global Change Biology 11, 940-944.
[30] Cannon R.J.C. (1998). The implications of predicted climate change in the UK, with emphasis on non-indigenous species. Global Change Biology 4, 785-796.
[31] Auger-Rozenberg M.A., Barbaro L., Battisti A., Blache S.,. Charbonnier Y., et al. (2015). Ecological responses of parasitoids, predators and associated insect communities to the climate-driven expansion of pine processionary moth. pp. 311- 358 In Roques A. (Ed.) Processionary Moths and Climate Change: An Update. Springer/ Quae
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : ROQUES Alain, AUGER-ROZENBERG Marie-Anne (24 novembre 2018), Changement climatique et mondialisation, moteurs des invasions d’insectes, Encyclopédie de l’Environnement. Consulté le 31 mars 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/changement-climatique-mondialisation-invasion-insectes/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







