Comment les plantes supportent-elles un régime salé ?
PDF
Des sols peuvent être salinisés naturellement, par exemple à cause des embruns marins. Mais ils peuvent l’être aussi à cause des activités humaines. Ce dernier phénomène est un problème qui touche 20 à 30% des 260 millions d’hectares de terres irriguées dans le Monde. Un certain nombre de plantes poussent naturellement en conditions salines, au bord de la mer par exemple, malgré la toxicité cellulaire de l’ion sodium présent en grande quantité. Toutefois, la majorité des plantes -et en particulier celles qui sont utilisées en agriculture, comme le riz- sont sensibles à un excès de sel dans le sol. C’est un problème de sécurité alimentaire qui préoccupe la recherche internationale. Plusieurs décennies de recherche ont permis d’aboutir à une bonne compréhension de la toxicité liée à la salinité et aux mécanismes adaptatifs chez les plantes. Opportunément, ces connaissances sont maintenant mises à profit pour obtenir de nouvelles variétés de plantes cultivées plus tolérantes à la salinité des sols ; avec comme graal, pourquoi pas, des cultures de céréales arrosées avec de l’eau salée !
1. Les plantes face au sel
1.1. Les plantes tolérantes

Dans les marais salants on rencontre les salicornes (Salicornia sp.), qui regroupent une trentaine d’espèces comestibles, et sur les dunes l’euphorbe maritime (Euphorbia paralias), le chiendent des sables (Elymus farctus) ou le magnifique lys de mer (Pancratium maritimum).

Les halophytes peuvent tolérer des concentrations en sel de l’ordre de 500 mM à 1 M, en exacerbant l’efficacité des mécanismes de gestion de la toxicité de l’ion sodium Na+. [2] Certaines plantes comme la salicorne nécessitent cet ion pour pouvoir croître, ce sont les halophytes strictes.
Ces écosystèmes pourtant ingrats se prêtent à l’agriculture ; ainsi, le pastoralisme des prés-salés (Figure 2) donne un exemple d’une pratique agricole avec des moutons élevés et nourris avec la flore halophile adaptée à la salinité du sol, à la submersion et la sécheresse parmi lesquelles la puccinellie (Puccinellia maritima, une graminée), le troscart (Triglochin maritima) ou l’obione (Halimione portulacoïdes).
1.2. Les plantes sensibles

La croissance et le développement des glycophytes sont affectés dans les sols salins, en raison de la présence en excès de sels solubles, essentiellement du cation sodium (Na+). Les symptômes visuels des dommages causés par le sel sont la chlorose de la pointe des feuilles, suivie de leur brûlure, du brunissement et de la mort des feuilles. On observe alors une croissance réduite des plantes, des racines qui ne se développent plus, une stérilité et une production de graines réduite.
L’extension de la salinisation des sols est un problème environnemental majeur : chaque année, ce sont 10 millions d’hectares de terres agricoles qui sont détruits dans le monde par la salinisation des sols. Le changement climatique, l’utilisation excessive des eaux souterraines, l’utilisation croissante d’eau d’irrigation de mauvaise qualité, l’irrigation massive dans une zone à climat semi-aride à aride et un manque de lixiviation [4] des sols peuvent intensifier ce phénomène de salinisation des sols (Lire Focus Salinisation des sols). Depuis plusieurs décennies, la recherche en biologie végétale a permis de beaucoup mieux comprendre les mécanismes de toxicité liés à la salinité et ceux qui permettre aux plantes de s’y adapter (Lire Focus Biotechnologie végétale et tolérance à la salinité des plantes cultivées).
2. Toxicité de l’ion Na+ dans les cellules végétales
L’ion Na+, en forte concentration dans le sol, entraîne un ensemble de processus délétères pour la croissance et le développement de la plante :
- D’une part, une concentration élevée en sel dans la solution du sol augmente son potentiel hydrique [5] ; cela va perturber la nutrition des plantes en eau et en nutriments par l’intermédiaire des racines.
- D’autre part, la plante ne peut empêcher à long terme l’entrée du Na+ dans ses cellules racinaires et sa translocation vers la partie aérienne, provoquant une intoxication cellulaire généralisée.
Un modèle en deux phases a ainsi été proposé pour expliquer les mécanismes délétères dus à un excès en ion Na+ :
- des effets précoces liés à l’augmentation de la pression osmotique externe ;
- des effets plus tardifs liés à l’accumulation de Na+ dans les cellules.
2.1. Eau, sel et potentiel hydrique
La présence de sel dans le sol impacte son potentiel hydrique. Ce potentiel est l’énergie qu’il faut appliquer au sol pour libérer 1g d’eau. Il est toujours négatif, et est d’autant plus bas que la liaison entre l’eau et le sol est forte. [6] L’eau pure possède un potentiel hydrique de 0 ; mais dans un sol, l’eau n’est pas pure et contient aussi des solutés, responsables de la baisse du potentiel hydrique. Il est donc défini :
- par sa teneur en eau. Ainsi un sol bien hydraté aura un potentiel hydrique avec des valeurs d’environ -0,1 MPa, alors qu’un sol sec aura des valeurs d’environ -1 MPa.
- par la concentration en solutés du sol. Ainsi, cette valeur peut atteindre environ -0,4 MPa dans un sol contaminé par une solution saline à 150 mM NaCl.
Pour comprendre l’importance de ces paramètres physico-chimiques dans les problèmes de salinité, il faut prendre en compte le potentiel hydrique des cellules racinaires. En conditions normales, ces dernières présentent une valeur de potentiel hydrique d’environ -0,5 MPa.
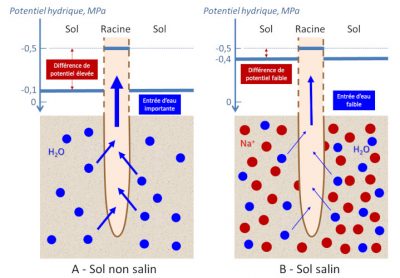
Lorsque le sol est contaminé par une solution saline à 150 mM NaCl, cette différence de potentiels hydriques se réduit à 0,1 MPa (Figure 4B). Or cette différence de potentiel hydrique est l’une des forces motrices des flux d’eau au travers de la membrane cellulaire. On peut estimer qu’en dehors de toute réponse cellulaire adaptative à la salinité, ce moteur est 4 fois moins efficace pour transférer l’eau du sol vers l’intérieur des racines en conditions de salinité par rapport à la condition normale !
Dans une situation extrême où la salinité du sol serait plus importante, on pourrait assister théoriquement à une sortie de l’eau des cellules racinaires vers le sol salin, et à une déshydratation de la plante par ses racines ! Ce phénomène rappelle celui du stress hydrique qui peut avoir plusieurs causes (sécheresse, gel, …) et intervient lorsque le sol n’est pas en capacité de fournir suffisamment d’eau liquide aux racines pour assurer l’hydratation des tissus et l’évaporation par les feuilles (Lire La vie fixée des plantes).
Les dommages dus à l’effet osmotique de la salinité impactent non seulement la turgescence des cellules, mais induisent des changements métaboliques similaires à ceux causés par le stress hydrique. Par exemple, le stress osmotique a un effet immédiat sur le taux de croissance des plantes.
2.2. Salinité, photosynthèse et stress oxydatif
- La photosynthèse est altérée, à cause de la fermeture des stomates, phénomène contrôlé par l’hormone acide abscissique, et l’inhibition de la fixation du CO2 ;
- Le transfert linéaire des électrons au travers du photosystème II est inhibé, le transfert cyclique d’électrons au sein du photosystème I est quant à lui activé ;
- Le mécanisme de protection du quenching non photochimique mis en place pour évacuer l’excès d’énergie lumineuse sous forme de fluorescence est exacerbé [8] (Lire Focus Z comme photosynthèse).
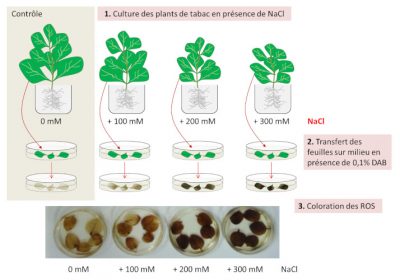
La conséquence immédiate de ces désordres dans la photosynthèse est la production de formes activées de l’oxygène (ROS, pour Reactive Oxygen Species) et l’expression des enzymes impliquées dans la prise en charge du stress oxydatif pour empêcher les dommages aux photosystèmes, lipides, protéines et acides nucléiques. Cependant, l’une des ROS, le peroxyde d’hydrogène (H2O2), présente également un rôle de signalisation cellulaire dans la tolérance au sel. Ainsi, il y a un mécanisme de coordination entre la production de ROS, leur élimination par des enzymes et une quantité suffisante requise pour la signalisation cellulaire (Figure 5). [9]
2.3. Pourquoi Na+ est-il toxique ?
La toxicité spécifique de l’ion Na+ pourrait être due à ses propriétés physicochimiques proches de celles du K+ (Potassium). Dans tous les organismes vivants, K+ est le principal cation inorganique du cytosol, où sa concentration (environ 0,1 M) est généralement plusieurs fois supérieure à celle de Na+. Il joue un rôle essentiel dans la physiologie de la plante. Du fait de son abondance intracellulaire, c’est le contre-ion inorganique majeur des charges négatives des protéines et des acides nucléiques, avec en particulier des fonctions d’activation de plus de cinquante réactions enzymatiques [10] (Lire Focus Potassium et Sodium : de faux jumeaux !).
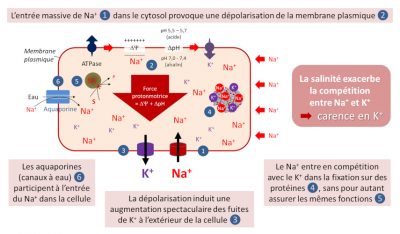
- Le Na+ entre en compétition avec le K+ pour l’absorption de ce dernier dans la cellule racinaire, car les deux ions sont transportés au travers de la membrane plasmique par plusieurs systèmes de transport identiques (canaux cationiques non sélectifs de type NSCC et transporteurs à haute affinité HKT). Ce phénomène est exacerbé en situation de stress salin.
- Le Na+ a des effets délétères à la surface de la cellule, car il vient perturber gravement la polarisation électrique de la membrane plasmique. Cette dépolarisation conduit à une augmentation spectaculaire des fuites de K+ à l’extérieur de la cellule, par le biais des canaux à K+ activés par la dépolarisation (canaux dénommés KOR).
- Le Na+ entrerait en compétition avec le K+ dans la fixation sur des protéines importantes, sans pour autant assurer les mêmes fonctions que ce dernier. Un excès en Na+ dans le cytosol inhiberait ainsi l’activité de nombreuses réactions enzymatiques entraînant un dysfonctionnement cellulaire, par exemple sur l’activité photosynthétique des plantes.
- Des données récentes indiquent que les aquaporines (canaux à eau) de la membrane plasmique, connues principalement pour leur activité de transport d’eau et de solutés neutres, participent, elles aussi, à l’entrée du Na+ dans la cellule !
Ainsi, malgré la présence de K+ dans le sol, on peut dire que la salinité provoque chez la plante une carence en ce nutriment !
3. Mécanismes de tolérance à la salinité chez les plantes
3.1. Qu’est-ce qu’un stress salin ?
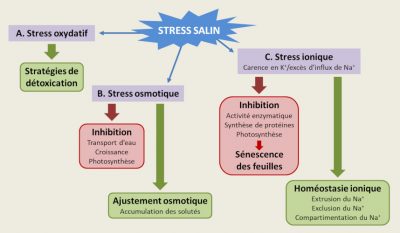
- Le stress oxydatif rencontré lors du stress salin doit être géré au niveau cellulaire par des mécanismes de protection et de réparation des dommages.
- La réponse au stress osmotique permet de maintenir l’homéostasie de l’eau par une biosynthèse de solutés compatibles et l’implication des aquaporines (canaux d’eau).
- Ces mécanismes impliquent la fonction et la régulation des systèmes de transport du Na+ et/ou du K+ impliqués dans la réponse au stress ionique (Figure 7). [13]
3.2. Stratégies de détoxication contre le stress oxydatif
Le stress oxydatif, causé par le stress salin, chez des plantules de maïs a été observé principalement dans les racines et les feuilles matures, et dans une moindre mesure dans les jeunes feuilles (Figure 7A). Diverses stratégies de détoxications sont alors mises en place :
- Augmentation de la teneur en H2O2 et des marqueurs de dommages oxydatifs des membranes cellulaires (fuite d’électrolytes et peroxydation lipidique).
- Accumulation dans les cellules de molécules antioxydantes (polyphénols, flavonoïdes, ascorbate, …) et d’activités enzymatiques antioxydantes (catalase, superoxyde dismutase, peroxydase).
Des mécanismes de protection des ROS peuvent ainsi être activés dans toute la plante, comme c’est le cas dans de nombreuses autres situations de stress (Lire Comment les plantes supportent les stress alpins ?).
3.3. Comment maintenir l’homéostasie hydrique ?
Le maintien de l’équilibre hydrique dans les tissus de la plante (on parle aussi d’homéostasie hydrique) est crucial pour sa croissance et son développement. L’eau est perdue par la transpiration par les stomates et acquise par l’absorption racinaire. L’homéostasie hydrique est donc assurée par l’apport en eau, mais aussi par la capacité des cellules végétales à retenir l’eau.
En conditions de stress osmotique, l’homéostasie hydrique est perturbée (voir Figure 4), la cellule végétale accumule dans le cytosol des solutés compatibles afin d’équilibrer la pression osmotique (Figure 7). Il s’agit du saccharose, de la proline et la glycine bétaïne. Par exemple, on a décrit l’accumulation de proline comme osmolyte non toxique et protecteur dans un grand nombre de plantes soumis au stress salin.
3.4. Maintenir l’équilibre ionique ?
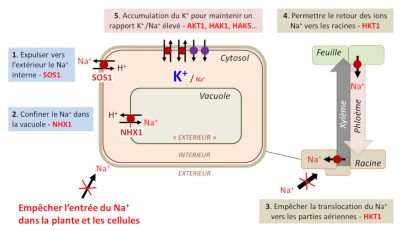
Pour qu’une plante soit en mesure de tolérer un stress salin, il est important que le rapport K+/Na+ dans le cytosol des cellules racinaires soit élevé et donc que ces cellules contiennent peu de Na+ (Figure 7C). Différentes stratégies permettent aux plantes d’y parvenir ; elles impliquent des systèmes de transport contribuant à l’homéostasie Na+ et K+ (Figure 8).
- Expulser l’excès d’ions Na+ hors des cellules épidermiques racinaires vers l’extérieur. La protéine appelée SOS1 [15] joue un rôle dans ce processus, c’est le seul système d’efflux de Na+ localisé à la membrane plasmique caractérisé jusqu’à présent chez les plantes.
- Confiner les ions Na+ dans la vacuole, une fois qu’ils sont dans le cytosol, grâce à l’activité de la protéine NHX1 [16].
- Empêcher la translocation des ions Na+ vers les parties aériennes. Ce rôle est dévolu à un transporteur d’influx sélectif de Na+ de la famille HKT1. Localisé dans le parenchyme du xylème racinaire, il permet de décharger en Na+ la sève xylémienne, en retenant cet ion dans les cellules du parenchyme xylémien. Le locus Saltol porte le gène codant pour ce système de transport.
- Permettre le retour des ions Na+ vers les racines. HKT1 est aussi exprimé dans les cellules adjacentes aux vaisseaux du phloème dans les feuilles ; cela permettrait la recirculation du Na+ des parties aériennes, en chargeant le Na+ dans le phloème pour permettre le retour.
- Contrecarrer les effets toxiques du Na+ grâce à l’implication des systèmes de transport du K+. Ces systèmes aident au maintien d’un rapport K+/Na+ cytosolique élevé. Par exemple, chez le riz, la mutation individuelle des gènes AKT1, HAK1 et HAK5, codant, respectivement, pour un canal et deux transporteurs de K+ provoque une plus forte sensibilité au stress salin chez les plantes mutées. Ceci démontre que la nutrition en K+ joue un rôle majeur dans la tolérance à la salinité des sols (Figure 8).
4. Le sodium peut être utile aux plantes !

La concentration de K+ dans le sol de l’ordre du millimolaire permet une croissance optimale des plantes. La disponibilité des ions K+ dans la solution du sol, lentement libérés par les particules du sol et les argiles, est souvent limitante pour une croissance optimale dans la plupart des écosystèmes naturels. Quand la concentration en K+ dans le sol est très basse, de l’ordre de la micromolaire, le Na+ peut le substituer dans certaines fonctions vitales, comme son rôle de soluté pour maintenir l’osmolarité dans la cellule (Lire Focus Potassium et Sodium : de faux jumeaux !).
Environ 90% du K+ est stocké dans la vacuole où il y assure un rôle osmotique. Confiné dans la vacuole, le Na+ peut jouer ce même rôle ; la cellule mobilise alors le K+ dans le cytosol où il y assure son rôle métabolique. Un système de transport du Na+ spécifiquement exprimé lorsque la concentration en K+ dans le sol est faible permettrait d’absorber le Na+ dans la plante pour cet usage bénéfique [17]. Le Na+ peut ainsi stimuler la croissance des plantes, à de faibles concentrations.
Les plantes halophiles peuvent avoir besoin de certaines concentrations en NaCl pour croître correctement, comme chez Atriplex vesicaria (arbuste d’Australie proche cousin de l’obione Halimione portulacoïdes présent dans les prés salés en France, Figure 9), Echinochloa utilis (millet japonais) ou Portulaca grandiflora (un pourpier).
5. Messages à retenir
- Dans le Monde, 20% des terres irriguées sont menacées par la salinisation progressive des sols :
– les plantes d’intérêt agronomique tolèrent peu ou pas la salinité des sols ;
– seule, la végétation halophile est adaptée à pousser en conditions salines. - L’ion sodium (Na+) est le principal responsable de la toxicité due au sel en perturbant :
– l’absorption en eau et en nutriments par les racines ;
– la photosynthèse dans les feuilles ;
– mais aussi en accumulant des formes activées de l’oxygène conduisant à un stress oxydatif. - Du fait de leurs propriétés physico-chimiques similaires, Na+ entre en compétition avec l’ion potassium (K+), un élément nutritif majeur chez les plantes.
- Les plantes réagissent à la présence de Na+ en plusieurs étapes :
– En se protégeant contre le stress oxydatif ;
– En accumulant des solutés pour contrecarrer l’effet osmotique qu’exerce une quantité trop importante de Na+ dans le sol ;
– En limitant l’absorption de Na+ dans la racine, en augmentant son expulsion en dehors des cellules racinaires, le confinant dans la vacuole, et en gérant son transport et son exclusion hors des feuilles. La plante améliore aussi sa nutrition en K+.
Notes et références
Image de couverture. Rizière à Cat Bà (Vietnam). [Source : © Doan Trung Luu]
[1] On parle aussi de plantes halophiles, par opposition aux plantes glycophiles ou « glycophytes » qui poussent dans les milieux dépourvus de sel.
[2] Flowers T.J., Galal H.K., & Bromham L. (2010). Evolution of halophytes: multiple origins of salt tolerance in land plants. Funct. Plant Biol. 37, 604–612. doi: 10.1071/FP09269
[3] Munns R. & Tester M. (2008) Mechanisms of Salinity Tolerance. Ann. Review Plant Biol. 59: 651-681
[4] La lixiviation désigne le processus permettant au sol d’être débarrassé par l’eau des composés solubles impropres à la culture. Il se différencie du terme lessivage qui concerne les composés non solubles.
[5] L’eau, de l’absorption à la transpiration
[6] Il est exprimé avec des unités de pression comme le Pascal (Pa)
[7] Rengasamy P., North S. & Smith A. (2010) Diagnosis and management of sodicity and salinity in soil and water in the Murray Irrigation region. The University of Adelaide, SA.
[8] Stepien P. & Johnson G.N. (2009) Contrasting Responses of Photosynthesis to Salt Stress in the Glycophyte Arabidopsis and the Halophyte Thellungiella: Role of the Plastid Terminal Oxidase as an Alternative Electron Sink. Plant Physiology 149 (2) 1154-1165; DOI: 10.1104/pp.108.132407
[9] Yadav N.S., Shukla P.S., Jha A. et al. (2012) The SbSOS1 gene from the extreme halophyte Salicornia brachiata enhances Na+ loading in xylem and confers salt tolerance in transgenic tobacco. BMC Plant Biol 12, 188. https://doi.org/10.1186/1471-2229-12-188
[10] Bhandal I.S. & Malik C.P. (1988) Potassium estimation, uptake, and its role in the physiology and metabolism of flowering plants. Int. Rev. Cytol. 110: 205-254
[11] Les schémas généraux de cet article sont originaux, mais inspirés par de nombreux schémas pédagogiques. Le plus emblématique d’entre eux est « Teaching tools in Plant Biology (2014) Plant Nutrition 1: Membrane transport and Energetics, Potassium nutrition, and Sodium toxicity. DOI: https://doi.org/10.1105/tpc.114.tt0914. »
[12] Munns R. & Tester M. (2008) Mechanisms of Salinity Tolerance. Annu. Rev. Plant Biol. 59, 651–681.
[13] Plant Nutrition 1: Membrane Transport and Energetics, Potassium Nutrition, and Sodium Toxicity
[14] Ce gène est appelé Saltol (pour Salt Tolerance). Il code un transporteur d’influx sélectif de Na + de la famille HKT1. Le génome du riz a été entièrement séquencé en 2005. On dispose désormais du répertoire de ses quelque 37 500 gènes. Il est possible d’associer n’importe quel caractère agronomique visible et mesurable (le phénotype), telle la tolérance à la sécheresse, à la salinité ou la hauteur des plantes, à un ensemble de gènes (le génotype).
[15] SOS1 pour Salt Overly Sensitive ; il s’agit d’un antiport Na+/H+. Un antiport est une protéine membranaire impliquée dans le transport actif d’ions différents à travers une membrane, telle que la membrane plasmique, dans des sens opposés Na+ dans un sens et H+ dans l’autre.
[16] Il s’agit d’un antiport Na+/H+ de type NHX1.
[17] Horie T., Costa A., Kim T. H., Han M.J., Horie R., Leung H.-Y., Miyao A., Hirochika H., An G. & Schroeder J.I., (2007) Rice OsHKT2;1 transporter mediates large Na+ influx component into K+-starved roots for growth. EMBO J. 26, 3003–3014.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : LUU Doan Trung (17 septembre 2020), Comment les plantes supportent-elles un régime salé ?, Encyclopédie de l’Environnement. Consulté le 31 mars 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/comment-plantes-supportent-regime-sale/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







