Contraintes environnementales et stress oxydant chez les plantes
PDF
Les plantes ne peuvent pas se déplacer et sont donc particulièrement exposées aux fluctuations de l’environnement et aux attaques extérieures. Les conditions environnementales sont très rarement optimales, ce qui entraîne la notion de contrainte ou stress qui impacte la croissance et le développement des plantes. Les contraintes environnementales englobent les stress biotiques, provoqués par un organisme vivant, et abiotiques, causés par des facteurs environnementaux. Les données récentes en biologie cellulaire et moléculaire montrent qu’un certain nombre de mécanismes de réponse aux stress sont partagés par les plantes et les animaux, la cellule étant le point commun, voire la cible commune, de tous ces êtres vivants. En particulier, les molécules toxiques oxydantes, présentes au cours des stress abiotiques, jouent des rôles similaires dans les cellules animales et végétales. Cet article se focalise sur les stress abiotiques subis par les plantes, qui ont été amenées à développer un système de réponse particulièrement complexe afin de pouvoir s’adapter et survivre.
- 1. Les stress abiotiques
- 2. Les espèces réactives de l’oxygène (ERO)
- 3. Rôles des ERO dans la réponse aux stress abiotiques
- 4. Les ERO et les relations de signalisation entre organites cellulaires et noyau
- 5. Perspectives d’utilisation des connaissances sur les réseaux de signalisation
- 6. Messages à retenir
1. Les stress abiotiques
Le mot stress désigne l’agression que subit un organisme vivant puis la réaction de celui-ci à l’état de perturbation qui en résulte. Étymologiquement, le mot « stress » est emprunté du même mot anglais, mais il provient à l’origine de l’ancien français « déstresse », qui correspond à détresse.
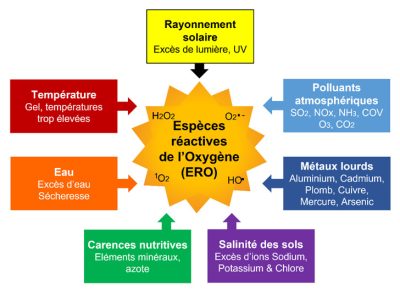
Les stress abiotique [1] causés par une grande variété de facteurs environnementaux indépendants des êtres vivants comprennent les éléments suivants (Figure 1) :
- Température :
– Périodes de gels (particulièrement gel tardif)
– Températures trop élevées (surtout sur de longues périodes, ce qui se produit de plus en plus souvent, en liaison avec le changement climatique) ; (Lire Effets de la température sur la photosynthèse) - Eau :
– Excès d’eau (inondations entrainant une asphyxie racinaire)
– Manque d’eau provoquant des sécheresses (Lire Besoins en eau des plantes : comment les satisfaire ?) - Rayonnement Solaire : excès de lumière, UV (Lire Impact cellulaire des UV solaires)
- Carences nutritives : éléments minéraux (en particulier magnésium), azote
- Salinité des sols : excès des ions sodium et chlore (Lire focus Salinisation des sols)
- Pollution des sols : métaux lourds (cadmium, plomb, mercure, cuivre, aluminium, …)
- Pollution atmosphérique : (Lire Quel est l’impact des polluants de l’air sur la végétation ?)
– Polluants primaires : dioxyde de soufre (SO2), oxydes d’azote (NOx), ammoniac (NH3), composés organiques volatils (COV)
– Polluant secondaire : ozone (O3). Ce composé gazeux est un polluant photochimique. Il résulte d’interactions, en présence d’UV, entre le dioxygène O2, les oxydes d’azote (NO et NO2) et les composés organiques volatiles (COV). La concentration de ce composé fortement phytotoxique a considérablement augmenté dans la troposphère entre le 19e siècle et les années 2000. Actuellement, sa concentration moyenne annuelle plafonne aux USA et en Europe mais continue d’augmenter en Asie. Cependant, des pics aigus de concentration surviennent sur de courtes périodes et peuvent entraîner des dommages aux plantes [2].
– Dioxyde de carbone (CO2) : ce composé occupe une place à part et sa présence dans la liste des polluants atmosphériques peut surprendre. Le CO2 constitue en effet la source de carbone essentielle pour la croissance végétale (photosynthèse). Cependant, l’augmentation considérable de sa teneur dans l’air depuis la fin du 19e siècle (sa concentration est passée de 290 ppm au début de la Révolution industrielle à près de 420 ppm actuellement), interroge sur la capacité des plantes à réguler ce surcroît d’apport carboné. Il semble que l’augmentation de CO2 se traduit par une croissance de la surface foliaire permettant une augmentation proportionnelle de la photosynthèse [3]. Cependant, à l’échelle de la croissance de la végétation terrestre, d’autres contraintes, telles la sécheresse, l’augmentation de température et/ou la rupture de l’équilibre carbone/azote, pourraient entraver cette relation [4].
Très souvent, les plantes sont soumises à des contraintes simultanées. Deux cas sont intéressants dans ce contexte :
- L’interaction entre l’augmentation du CO2, à priori bénéfique, et celle de l’ozone dont la toxicité est patente [7].
- La sécheresse combinée à la présence d’ozone, qui peuvent toutes deux être préjudiciables au développement des plantes [8].
Dans ce dernier cas, la manière dont les deux contraintes se produisent dans le temps peut faire passer leur interaction de synergique (action coordonnée) à antagoniste (effet opposé). Ainsi, les risques de dommage sur les plantes sont plus importants lorsque la pollution ozone se produit au printemps avant que la sécheresse ne débute, par rapport à une sécheresse précoce ou simultanée à la pollution ozone, qui ferait fermer les stomates et amoindrirait la pénétration du polluant.
Les plantes sont capables de développer des mécanismes de perception et de réponse vis-à-vis des contraintes environnementales, leur permettant de se défendre en manifestant une certaine adaptation. Cependant, si la contrainte s’intensifie et dépasse les capacités défensives de la plante, celle-ci peut mourir.
Ce qui est remarquable, c’est que chacune des diverses contraintes environnementales auquel les plantes doivent faire face aboutit à un même type de stress : un stress oxydant (ou stress oxydatif, par anglicisme d’« oxidative stress »), s’exprimant au niveau cellulaire. Le stress oxydant proviendrait d’un déséquilibre entre la production, ou plutôt la surproduction, d’espèces réactives de l’oxygène (ERO ; en anglais ROS, Reactive Oxygen Species) et les capacités cellulaires antioxydantes [9] (Figure 1).
2. Les espèces réactives de l’oxygène (ERO)
2.1. Nature chimique et mécanismes de production des ERO

- O2 −, ion superoxyde ;
- HO, radical hydroxyle ;
- HO2, radical perhydroxyle.
Enfin, RO2•, radical peroxyle et RO•, radical alkoxyle sont des radicaux secondaires impliquant des composés organiques R oxydés par 1O2 ou HO•.
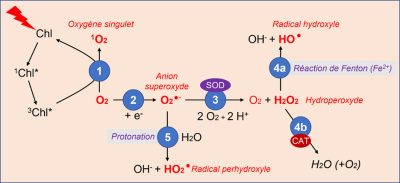
Ces diverses molécules sont formées au sein de la cellule à partir de l’oxygène (Figure 3) :
- L’oxygène, produit par la photosynthèse, reçoit de l’énergie de la chlorophylle excitée par la lumière (état triplet 3Chl*), et donne naissance à de l’oxygène singulet 1O2 (Figure 3).
- Des électrons disponibles lors de réactions biochimiques intracellulaires peuvent réagir avec l’oxygène pour former des ions superoxydes, O2 −.
- L’ion superoxyde se transforme assez facilement en hydroperoxyde H2O2 sous l’action de l’enzyme superoxyde dismutase (SOD).
- L’hydroperoxyde est ensuite transformé :
- En présence d’ions ferreux, il donne le radical hydroxyle HO lors de la réaction de Fenton ;
- Il peut aussi être décomposé grâce à des catalases (CAT), enzymes qui protègent l’organisme de l’action oxydante et néfaste de l’hydroperoxyde (voir 2.4).
- De son côté, l’ion superoxyde peut produire le radical perhydroxyle HO2 par protonation.
2.2. Sites de production des espèces réactives de l’oxygène
Les ERO sont produits normalement dans tous les compartiments cellulaires, plastes (chloroplastes dans les parties aériennes), mitochondries, peroxysomes/glyoxysomes, cytosol, membrane plasmique, apoplaste (paroi cellulaire) (Figure 4). Les chloroplastes sont la source majoritaire des ERO dans les tissus photosynthétiques. Les mitochondries sont d’importants producteurs d’ERO surtout dans les tissus non-photosynthétiques.
- Chloroplastes
Au cours des processus photochimiques de la photosynthèse (Lire Lumière sur la photosynthèse & Le chemin du carbone dans la photosynthèse) des fuites d’énergie et d’électrons se produisent tout à fait naturellement :
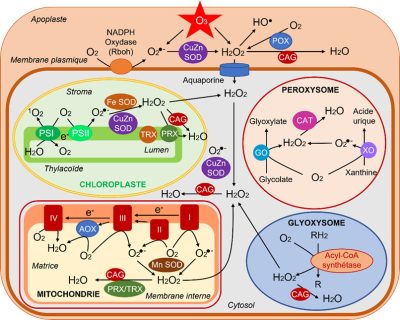
– La formation de 1O2 est favorisée par une limitation de l’entrée de CO2 suite à la fermeture des stomates, souvent observée lors de stress. La diminution de CO2 provoque un ralentissement des réactions biochimiques se traduisant par une moindre demande en produits des réactions photochimiques et un engorgement électronique (surréduction) concomitant.
– Au niveau du photosystème I, de l’oxygène capte des électrons pour donner de l’ion superoxyde O2 −. Celui-ci peut être transformé en une autre ERO, l‘hydroperoxyde H2O2 à l’aide d’enzymes, les superoxyde dismutases (SOD) (voir paragraphe 2.4).
- Mitochondries
Dans les mitochondries, lors de la respiration, des fuites d’électrons se produisent naturellement au niveau des complexes respiratoires, conduisant à la production d’ions superoxydes O2• −. Ceux-ci peuvent être transformés par une SOD en H2O2.
- Peroxysomes
Dans les peroxysomes, la source principale d’ERO est la réduction du glycolate en glyoxylate par la glycolate oxydase qui utilise O2 pour donner H2O2. Des ions O2•− peuvent aussi être produits lors du fonctionnement de l’enzyme xanthine oxydase et transformés en H2O2 par une SOD peroxysomale.
- Glyoxysomes
Dans les glyoxysomes, la β-oxydation [11] des acides gras produit de l’hydroperoxyde H2O2.
- Membrane plasmique & apoplaste
La membrane plasmique renferme une NADPH oxydase [12] qui délivre dans l’apoplaste des ions superoxyde O2• − formés à partir de l’oxygène. Dans l’apoplaste, on trouve de l’hydroperoxyde qui provient soit (i) de la transformation des ions superoxyde par une SOD, (ii) de l’action de peroxydases (POX), et (iii) directement de la transformation de l’ozone O3. Enfin, des radicaux HO• proviennent de H2O2 dans ce milieu plutôt acide (pH autour de 5). [13]
2.3. Toxicité des ERO
- L’oxygène singulet 1O2
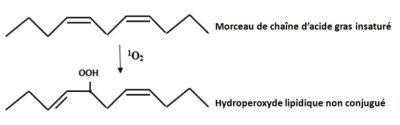
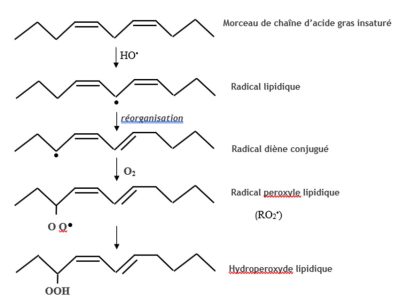
Il a une assez faible durée de vie, de l’ordre de 3 à 4 microsecondes (µs), et se déplace peu en dehors de son lieu de production, essentiellement chloroplastique. Il est cependant très réactif et attaque les pigments des photosystèmes, la protéine D1 du photosystème II, les nucléosides de l’ADN et les lipides membranaires (Figure 5). L’oxygène singulet réagit avec les doubles liaisons des acides gras polyinsaturés pour former des hydroperoxydes lipidiques ROOH.
- Les radicaux hydroxyles HO
Malgré une durée de vie très faible, de l’ordre de la microseconde (µs), les radicaux hydroxyles HO• possèdent la plus forte réactivité des ERO. Ils diffusent donc très peu et agissent sur leur lieu de production :
– Ils attaquent les doubles liaisons des bases nucléiques de l’ADN, pouvant conduire à la coupure des brins de l’ADN.
– Les acides aminés des protéines sont des cibles des HO, ce qui peut causer l’inactivation du site actif de protéines enzymatiques.
– Le radical hydroxyle peut aussi attaquer, par peroxydation lipidique, les doubles liaisons des acides gras polyinsaturés des phospholipides membranaires et des lipoprotéines (Figure 6).
A côté des radicaux peroxyles lipidiques RO2•, des radicaux alkoxyles RO• peuvent être produits, en présence de Fe2+, à partir des hydroperoxydes lipidiques. Ces radicaux très oxydants participent à la propagation des réactions de peroxydation lipidique en chaîne, conduisant à une diminution de la fluidité des membranes.
L’aboutissement ultime du processus de dégradation conduit à la formation d’aldéhydes en particulier le dialdéhyde malonique (malondialdehyde = MDA en anglais). Ce dernier est souvent considéré comme marqueur d’un stress oxydant sévère. Des radicaux RO2• (peroxyle) et RO• (alkoxyles) sont aussi formés lors des réactions d’oxydation des chaînes polypeptidiques constitutives des protéines.
- L’ion superoxyde O2−
- L’hydroperoxyde H2O2
Il a une durée de vie encore plus longue, jusqu’à la seconde, ce qui lui permet de circuler dans la cellule en traversant les différentes membranes, probablement en utilisant les aquaporines (voir Figure 7). Il est considéré comme peu réactif et possède un rôle de molécule signal.
Ces deux derniers ERO sont cependant tout à fait capables, s’ils sont présents en forte concentration, d’oxyder lipides et protéines. Comme nous le verrons plus loin (paragraphe 3), les cellules doivent réaliser un subtil équilibre entre production et destruction des ERO pour survivre, sinon elles entrent dans une spirale délétère conduisant à la mort cellulaire programmée (Programmed Cell Death = PCD en anglais).
2.4. Mécanismes de lutte contre les ERO
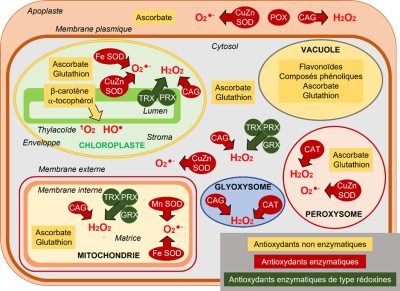
- Les flavonoïdes et composés phénoliques sont surtout représentés dans la vacuole.
- Le β-carotène et l’α-tocophérol sont présents dans le chloroplaste où ils neutralisent principalement l’oxygène singulet 1O2 mais aussi le radical HO.
- Les deux molécules antioxydantes les plus représentées sont l’ascorbate, synthétisé dans la mitochondrie, et le glutathion, dont la synthèse s’effectue dans les chloroplastes et le cytosol. Les concentrations en ascorbate sont globalement de 10 à 20 fois supérieures à celles du glutathion.
- L’ascorbate est majoritairement représenté dans les peroxysomes et le cytosol, mais les chloroplastes et les mitochondries en contiennent aussi de fortes concentrations. L’apoplaste en contient peu, même s’il constitue une première barrière aux attaques oxydantes.
- Le glutathion est majoritairement présent dans les mitochondries mais est quasiment absent de l’apoplaste.
- L’ascorbate et le glutathion peuvent individuellement participer à des opérations de détoxication d’ERO, mais leur rôle essentiel résulte de leur association dans le contexte du cycle ascorbate-glutathion (CAG), aussi appelé cycle Halliwell-Asada-Foyer, du nom des scientifiques qui l’ont identifié (Lire Focus Détoxication des hydroperoxydes). Ce mécanisme), est présent dans les chloroplastes, le cytosol et les mitochondries (Figure 7). Ce cycle détoxifie l’hydroperoxyde H2O2 (Figure 7).
- Des catalases (CAT), surtout dans les peroxysomes et les glyoxysomes, peuvent aussi dismuter H2O2 en H2O et O2 (Figures 4 & 7).
- Un autre groupe d’enzymes joue un rôle essentiel, voire préliminaire, puisque son rôle est la transformation de l’anion superoxyde O2− en hydroperoxyde H2O2. Ce sont les superoxyde dismutases (SOD), caractérisées par le métal présent dans leur site actif : Cuivre, Zinc, Fer ou Manganèse. Elles ont été identifiées dans les chloroplastes (CuZn-SOD thylacoïdale, Fe-SOD stromatique), dans les mitochondries (Mn-SOD), dans les peroxysomes (CuZn-SOD) et dans le cytosol (CuZn-SOD) (Figure 7).
Enfin, les rédoxines, thiorédoxines (TRX), glutarédoxines (GRX) et peroxyrédoxines (PRX), que l’on trouve dans les chloroplastes, les mitochondries et le cytosol, jouent un rôle important dans les processus de détoxication (Lire Focus Détoxication des hydroperoxydes).
3. Rôles des ERO dans la réponse aux stress abiotiques
3.1. Schéma général du fonctionnement des ERO
3.1.1. Impact d’un stress oxydant
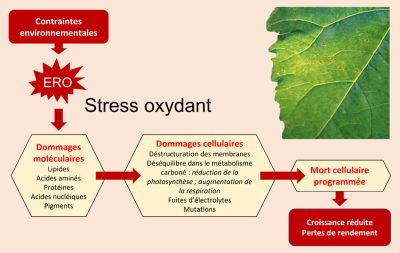
- Une déstructuration des membranes ;
- Des pertes d’électrolytes ;
- Des déséquilibres dans le métabolisme carboné incluant réduction de photosynthèse et augmentation respiratoire ;
- La mort cellulaire programmée comme ultime étape.
Pour contrecarrer ce scénario, les cellules végétales sont équipées, comme décrit au paragraphe précédent, de tout un arsenal de systèmes anti-oxydants, qui permettent de détruire les ERO afin de maintenir un équilibre propice à assurer la survie cellulaire.
3.1.2. Double fonction des ERO
3.2. Exemple de réponse à un stress oxydatif : la réponse à l’ozone des cellules foliaires
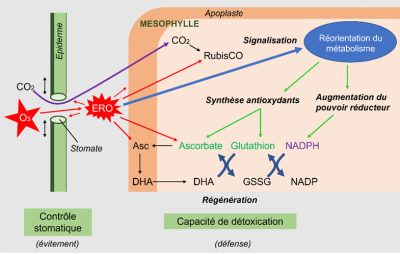
- La première réaction à l’agression s’apparente à de l’évitement, les stomates ayant tendance à se fermer. Cette réponse est observée lors de nombreux stress abiotiques même si elle semble naturelle dans le cas d’une sécheresse (éviter de perdre de l’eau) ou de l’ozone (empêcher la pénétration de l’espèce oxydante ozone). Cette fermeture a des conséquences négatives sur l’entrée du CO2, mais limite la production interne d’ERO.
- Ensuite, les ERO présents dans les espaces intercellulaires attaquent les cellules stomatiques et pénètrent dans l’apoplasme des cellules mésophylliennes. Les ERO sont détoxifiés par les antioxydants présents, essentiellement l’ascorbate.
Cependant, ces défenses constitutives sont relativement faibles et les ERO peuvent attaquer des cibles intracellulaires, comme l’enzyme chloroplastique fixatrice du carbone, la Rubisco.
Une augmentation des systèmes enzymatiques liés à la dégradation du carbone est souvent observée de manière concomitante avec, à la clé, une augmentation du pouvoir réducteur permettant le fonctionnement de systèmes antioxydants régénérant l’ascorbate. Ce système de défense, reposant sur l’équipement métabolique présent, ne peut perdurer si la teneur en ERO augmente :
- Lorsque les teneurs en ERO sont encore modérées, elles agissent parallèlement comme signaux et, par le biais de modifications de l’expression de gènes, permettent une réorientation du métabolisme en favorisant la synthèse d’antioxydants et de protéines enzymatiques impliquées dans la production de pouvoir réducteur. Les ERO sont aussi impliquées dans la synthèse des phytohormones qui agissent positivement ou négativement sur l’homéostasie cellulaire et interagissent entre elles.
- Lorsque les teneurs en ERO surpassent les capacités des cellules à déployer leur arsenal adaptatif, les structures cellulaires sont démantelées et les organites cellulaires perdent leur fonction, dans un processus de mort cellulaire programmée ou apoptose.
3.3. Perception du stress et signalisation cellulaire
3.3.1. Mode général de fonctionnement
La réponse au stress se compose de plusieurs étapes :
- Perception du stress,
- Implication de récepteurs membranaires,
- Mobilisation de signaux/messagers intracellulaires,
- Transduction/transmission des signaux à des facteurs de transcription
- Modifications de l’expression des gènes [16].
Le schéma en Figure 11 reflète, de manière assez simplifiée, l’état général des connaissances sur les systèmes de réception et transmission des signaux (Lire La vie fixée des plantes et ses contraintes). Les ERO sont clairement des acteurs incontournables, l’hydroperoxyde H2O2 en étant le représentant emblématique du fait de sa mobilité intracellulaire :
- H2O2 peut entrer dans le cytosol par le biais d’aquaporines dédiées, appelées peroxyporines.
- Dans le cytosol, H2O2 est à l’origine d’une cascade de kinases, les MAP kinases [17].
- H2O2 agit aussi sur des canaux du plasmalemme permettant l’entrée de calcium (3a) et sur des récepteurs imbriqués dans la membrane plasmique (3b, RLK de l’anglais Receptor-Like Kinase).
- La perception du signal de stress peut cependant mobiliser directement une RLK qui pourrait percevoir des changements de fluidité membranaire causés, par exemple, par des stress température (froid ou chaud excessif).
- Le calcium et les kinases dépendantes du calcium (CDPK ou Calcium-Dependent Protein Kinases, 5a) activent une enzyme NADPH-dépendante de type NADPH oxydase, la RBOH (Respiratory Burst Oxidase Homolog, 5b), qui produit l’ion superoxyde dans l’apoplaste, aussitôt transformé en H2O2.
- Le système en boucle reliant H2O2, le canal à Ca2+ et RBOH fonctionne comme un mécanisme de rétroaction positive synergique.
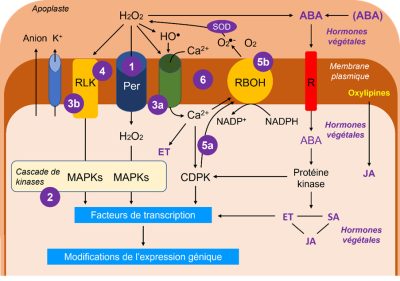
- ABA peut provenir de formes conjuguées ou voir sa synthèse stimulée par H2O2. ABA est reconnu par un récepteur spécifique dans la membrane plasmique et il est à l’origine d’un mécanisme le liant à la production d’autres phytohormones, l’éthylène (ET), l’acide salicylique (SA) et le jasmonate (JA).
- Le jasmonate peut provenir des oxylipines, produits de dégradation oxydative des acides gras polyinsaturés. Il est plutôt considéré comme protecteur.
- L’éthylène, est une phytohormone liée à la sénescence des tissus et organes et à des mécanismes de vieillissement cellulaire tandis que l’acide salicylique est généralement associé à des effets positifs en faible concentration mais toxiques à plus forte concentration.
Ces trois phytohormones interagissent constamment et vont entretenir un dialogue croisé (cross-talk en anglais) qui aura des répercussions sur les réponses aux stress. Si l’on considère l’ABA, son rôle sera décisif dans la fermeture des stomates, qui est conditionnée par une sortie d’anions et d’ions K+ provoquant un changement de potentiel osmotique. Mais le rôle de l’ABA est aussi important dans les cellules du mésophylle chlorophyllien.
L’ensemble des cascades de protéines kinases va activer des facteurs de transcription nécessaires à la régulation de l’expression des gènes. L’expression génique sera modifiée (stimulation et/ou répression de synthèse de protéines) en fonction des intervenants de ces cascades qui sont tributaires de l’intensité du stress.
Les chaînes de transmission des signaux peuvent présenter des spécificités partielles selon le type de stress abiotique, en particulier sécheresse, froid et salinité [19], métaux lourds [20], température élevée [21] et ozone [22].
3.3.2. Ajustement du fonctionnement en fonction de l’intensité du stress
Les mécanismes cellulaires de réponse au stress sont très complexes et les ajustements sont subtils. Il faut que le système réagisse en fonction du rapport de force entre une présence d’ERO supportable, permettant une régulation adaptée à l’aide d’une signalisation aboutissant à des mécanismes d’équilibre homéostatiques et une production excessive d’ERO débordant les défenses, désorganisant la régulation et provoquant la mise en place de mécanismes de destruction cellulaire conduisant à l’apoptose.
Lorsque le stress est d’assez faible intensité :
- Le contenu en ERO est maintenu à un niveau raisonnable, grâce à l’action des systèmes antioxydants enzymatiques et non-enzymatiques déjà présents dans les cellules et à leur synthèse accélérée liée au rôle de ces ERO dans une signalisation adaptée à la défense.
- Les cibles privilégiées des organes photosynthétiques sont les chloroplastes et la RubisCO est souvent affectée par les ERO, très précocement, même avant les photosystèmes. La synthèse des sous-unités de la protéine enzymatique est aussi réprimée.
- A l’inverse, une augmentation des systèmes de dégradation des composés glucidiques est souvent observée (métabolisme respiratoire), soit par augmentation des performances enzymatiques, soit par synthèse d’enzymes clés.
- Le déséquilibre de l’état redox cellulaire est alors évité par la production accrue de pouvoir réducteur, associé à tout ce métabolisme dégradatif. Le pouvoir réducteur sera aussi utilisé lors des réactions antioxydantes avec une augmentation de la synthèse de l’arsenal enzymatique associé.
- Le métabolisme primaire de production de composés carbonés est de toute manière modifiée avec moins de carbone assimilé et plus de carbone perdu par respiration, ce qui conduit à une raréfaction de la quantité totale de composés disponibles.
- En outre, pour combattre le stress, une déviation des voies de biosynthèse vers le métabolisme secondaire est aussi observée, conduisant à la production de composés flavonoïdes et phénoliques. Ces changements de répartition du carbone peuvent avoir, à long terme, un effet négatif sur la croissance des plantes.
A côté de ces réponses qui sont majoritairement communes à tous les types de stress abiotiques, certaines protéines sont synthétisées spécifiquement en fonction de la nature du stress :
- Osmoprotecteurs tels que proline et glycine bétaine (stress osmotiques, dont stress hydrique),
- Protéines de choc thermique HSP (Heat Shock Proteins, lors d’un stress de température élevée),
- Protéines contre l’agrégation/inactivation telles les LEA (Late Embryogenesis Abundant Protein) lors de stress sécheresse ou froid, etc….
Lorsque le stress s’intensifie, par augmentation de son mode d’action (augmentation de la température, de la concentration en ozone, de la teneur en sel ; etc…) ou lorsqu’il perdure très -trop- longtemps, la balance qui permet un juste équilibre entre production et destruction d’ERO est rompue. La signalisation se dérègle et les ERO jouent alors pleinement leur rôle toxique en déstructurant les membranes, en permettant la synthèse d’enzymes destructrices des protéines, conduisant à la désorganisation cellulaire et la mort de l’organe.
4. Les ERO et les relations de signalisation entre organites cellulaires et noyau
4.1. Équilibre redox et compartimentation cellulaire
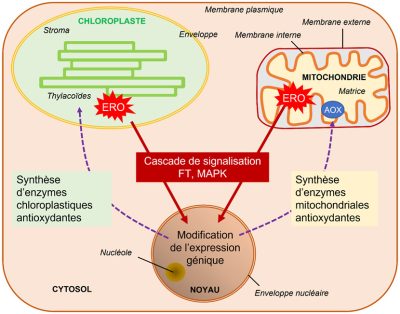
- Dans le cas des chloroplastes, l’oxygène singulet 1O2 provoque l’oxydation de caroténoïdes. Le produit de cette oxydation fait fonction de signal de stress [23]. L’aboutissement de cette signalisation rétrograde du chloroplaste au noyau est une modification de l’expression génique en faveur d’une photoacclimatation.
- Dans le cas des mitochondries, les stress abiotiques entraînent une augmentation de la production interne en ERO au niveau des complexes de la chaîne respiratoire (voir Figure 4). L’afflux d’électrons au niveau des différents éléments de la chaîne respiratoire provoque une augmentation du transport d’électrons dont la canalisation vers la transformation finale d’oxygène en eau devient difficile et cause un engorgement favorable à la production d’ions superoxyde O2–.. Un système de sauvegarde, consistant en une oxydase particulière, l’AOX (alternative oxydase, voir Figure 4), permet de capter directement les électrons et de réduire l’oxygène en eau sans participer à l’établissement de la force protomotrice nécessaire à la fabrication de l’ATP. Cette valve permet de minimiser la formation des ions superoxyde [24]. Il existe, aussi dans ce cas, une signalisation rétrograde, de la mitochondrie vers le noyau, qui pousse celui-ci à déclencher la synthèse de l’AOX (Figure 12).
La communication entre les organites cellulaires, chloroplastes et mitochondries, avec le noyau, par le biais d’une signalisation rétrograde, est donc essentielle pour maintenir l’homéostasie de l’énergie intracellulaire au moins lors de stress de faible et moyenne amplitude (Figure 12).[25]
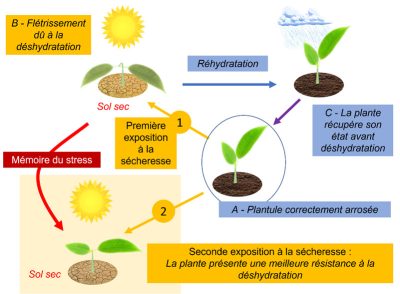
4.2. Effet mémoire et épigénétique
4.3. Réponse systémique
Enfin, il est important de comprendre les moyens par lesquels le signal de stress abiotique perçu par une partie d’une plante (feuille, racine) se répand dans toute la plante. La transmission du signal de stress à partir d’une feuille vers ses voisines répond au besoin de coordination de la réponse de tous les organes d’une plante à ce stress (réponse systémique). Cette coordination pourrait être réalisée par une vague d’auto-propagation de production de ERO, initiée au niveau d’un groupe de cellules foliaires et qui s’étendrait ensuite au reste de la plante [28].
5. Perspectives d’utilisation des connaissances sur les réseaux de signalisation
La question se pose d’une possible utilisation des découvertes sur les réseaux de signalisation et, en particulier, sur la multitude de facteurs de transcription qui sont impliqués. Les méthodes conventionnelles de sélection de variétés végétales tolérantes aux stress, quoique utiles, se révèlent posséder leurs limites. Des tentatives d’amélioration de la résistance au stress ont alors consisté à surexprimer certains types d’enzymes, par exemple impliqués dans la synthèse d’osmoprotecteurs. Mais la modification d’une seule enzyme ne suffit pas du fait de la multiplicité des réponses métaboliques aux stress.
En revanche, l’ingénierie génétique utilisant des protéines de régulation, tels les facteurs de transcription, pourrait être une approche plus séduisante pour faciliter la tolérance des plantes aux stress [29]. En effet, un seul facteur de transcription est capable de contrôler l’expression d’un nombre important de gènes et les connaissances actuelles permettent de relier le rôle de plusieurs de ces facteurs de transcription à la réponse des plantes aux stress abiotiques.
Des essais prometteurs ont déjà eu lieu par la création de plantes transgéniques utilisant des facteurs de transcription, notamment pour améliorer la tolérance à la sécheresse, au froid et à la salinité. Cependant, pour que cette technique soit profitable à l’obtention de plantes transgéniques stables et productives, des recherches sont encore nécessaires, en particulier au niveau du dialogue entre les différents composants de la signalisation et sur la régulation du comportement de ces plantes transgéniques dans des conditions environnementales favorables.
6. Messages à retenir
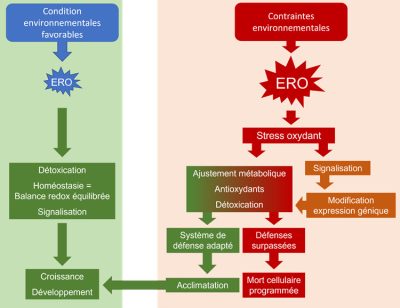
- Dans des conditions environnementales favorables, les plantes produisent habituellement des ERO, composés oxydants qui sont réputés toxiques pour les cellules végétales.
- La balance entre production et destruction des ERO est finement régulée, à l’aide du système antioxydant constitutivement présent. L’homéostasie cellulaire est assurée et, parallèlement, les ERO exercent un rôle majeur, en association avec les phytohormones, dans la signalisation cellulaire qui assure croissance et développement.
- Lorsque des contraintes environnementales se produisent, la production d’ERO est augmentée provoquant des modifications de l’état des membranes et de l’équilibre ionique.
- Les processus de signalisation, associant ERO et hormones, devront assurer le renouvellement des systèmes antioxydants non-enzymatiques et enzymatiques. Une réorganisation du métabolisme découle alors d’une modification de l’expression des gènes, commandée par les signaux issus des cascades de transmission cytosoliques (messagers, kinases, facteurs de transcription), mais aussi portés par les organites pourvoyeurs d’énergie, chloroplastes et mitochondries.
- Le signal de stress ERO-dépendant se transmet de cellule à cellule puis, de manière systémique, à l’ensemble de la plante, afin qu’une réponse adaptée soit proposée.
- Les ajustements résultant de cette mobilisation intracellulaire peuvent ne pas suffire lors de stress plus intenses ou qui se prolongent et les mécanismes de sauvegarde peuvent alors être débordés. La désorganisation membranaire liée à une attaque des ERO hors contrôle s’accompagne de ruptures de l’équilibre ionique et de l’homéostasie énergétique, entraînant alors une spirale délétère conduisant à la mort cellulaire programmée.
- Un effet mémoire semble être un avantage décisif permettant à une plante ayant subi un stress de répondre avec plus d’efficacité à la réitération de ce stress.
- L’ingénierie génétique pourrait permettre d’envisager la construction de plantes transgéniques surexprimant des facteurs de transcription impliqués dans la signalisation et l’expression de gènes d’adaptation, permettant d’améliorer la tolérance au stress. Dans le contexte actuel d’une augmentation de conditions environnementales défavorables sur les plantes, ces techniques seraient susceptibles de maintenir à un niveau acceptable leur productivité.
Notes et références
Image de couverture. Cette plante, Welwitschia mirabilis, pousse en Namibie dans un environnement chaud et sec. [Source : Photo P. Dizengremel]
[1] Par opposition aux stress biotiques résultant de l’action délétère d’un organisme vivant sur un autre organisme vivant telle qu’une attaque par un agent pathogène (bactéries, champignons, insectes, etc.)
[2] Dizengremel P (2021) L’ozone et les plantes, histoire d’une relation toxique. The Conversation, 2 mai 2021.
[3] Cernusak LA, Haverd V, Brendel O, Le Thiec D, Guehl JM & Cuntz M (2019) Robust response of terrestrial plants to rising CO2. Trends in Plant Science, 24, 578-586.
[4] Boretti A & Florentine S . (2019) Atmospheric CO2 concentration and other limiting factors in the growth of C3 and C4 plants. Plants, 8, 92 DOI:10.3390/plants8040092
[5] Dietz KJ, Zörb C & Geilfus CM (2021). Drought and crop yield, Plant Biology, 23, 881-893.
[6] Ainsworth EA, Yendrek CR, Sitch S, Collins WJ & Emberson LD (2012). The effects of tropospheric ozone on net primary productivity and implications for climate change. Annual Review of Plant Biology 63, 637-661. DOI:10.1146/annurev-arplant-042110-103829.
[7] Ainsworth EA, Lemonnier P & Wedow JM (2020). The influence of rising tropospheric carbon dioxide and ozone on plant productivity. Plant Biology 22, 5-11.
[8] Matyssek R, Le Thiec D, Löw M, Dizengremel P, Nunn AJ & Häberle KH (2006). Interactions between drought and O3 stress in forest trees. Plant Biology, 8, 11-17. DOI 10.1055/s-2005-873025.
[9] Das K & Roychoudhury A (2014). Reactive oxygen species (ROS) and response of antioxidants as ROS-scavengers during environmental stress in plants. Frontiers in Environmental Science, 2, 53. doi: 10.3389/fenvs.2014.00053.
[10] Le peroxyde d’hydrogène est plus connu sous sa formulation aqueuse : l’eau oxygénée.
[11] https://fr.wikipedia.org/wiki/B%C3%AAta-oxydation
[12] Souvent appelée Rboh, pour Respiratory burst oxidase homolog
[13] A noter qu’une production de HO• est aussi possible dans le lumen chloroplastique et dans l‘espace intermembranaire mitochondrial.
[14] Waszczak C, Carmody M & Kangasjärvi J (2018). ReactivOxygen Species in Plant Signaling. Ann. Rev. Plant Biol., 69, 209-236.
[15] Noctor G, Reichheld JP & Foyer C (2018). ROS-related redox regulation and signaling in plants. Semin. Cell Dev. Biol., 80, 3-12. doi: 10.1016/j.semcdb.2017.07.013.
[16] Paes de Melo B, Carpinetti PdA, Fraga OT, Rodrigues-Silva PL, Fioresi VS, de Camargos LF & Ferreira MFdS (2022). Abiotic stresses in plants and their markers: A practice view of plant stress responses and programmed cell death mechanisms. Plants, 11, 1100.
[17] MAP Kinases ou Mitogen-Activated Protein Kinases.
[18] Kumar M, Kesawat MS, Ali A, Lee SC, Gill SS & Kim HU (2019). Integration of abscisic acid signaling with other signaling pathways in plant stress responses and development. Plants, 8, 592. doi:10.3390/plants8120592.
[19] Boudsocq M & Laurière C (2005). Osmotic signaling in plants. Multiple pathways mediated by emerging kinase families. Plant Physiol., 138, 1185-1194. DOI : 10.1104/pp.105.061275.
[20] Berni R, Luyckx M, Xu X, Legay S, Sergeant K, Hausman JF, Lutts S, Cai G & Guerriero G (2019). Reactive oxygen species and heavy metal stress in plants: Impact on the cell wall and secondary metabolism. Env. Exp. Bot., 161, 98-106.
[21] Mansour A (2008). Heat schock activation of phospholipase C signaling pathway in tobacco cells. Plant Stress, 2, 131-137.
[22] Hasan MM, Rahman M, Skalicky M, Alabdallah NM, Waseem M, Jahan MS, Ahammed GJ, El-Mogy MM, El-Yazied AA, Ibrahim MFM & Fang XW (2021) Ozone induced stomatal regulations, MAPK and phytohormone signaling in plants, International Journal of Molecular Sciences, 22, 6304. https://doi.org/10.3390/ijms 22126304
[23] Shumbe L, D’Alessandro S, Shao N, Chevalier A, Ksas B, Bock R & Havaux M (2017) METHYLENE BLUE SENSITIVITY 1 (MBS1) is required for acclimation of Arabidopsis to singlet oxygen and acts downstream of β-cyclocitral Plant, Cell and Environment, 40, 216-226. doi: 10.1111/pce.12856.
[24] Gandin A, Dizengremel P &Jolivet Y (2021). Integrative role of plant mitochondria facing oxidative stress : the case of ozone. Plant Physiol. Biochem., 159, 202-210.
[25] Noctor G & Foyer C (2016). Intracellular redox compartmentation and ROS-related communication in regulation and signaling. Plant Physiol., 171, 1581-1592. doi/10.1104/pp.16.00346.
[26] Ding Y, Fromm M & Avramova Z (2012) Multiple exposures to drought ‘train’ transcriptional responses in Arabidopsis. Nat. Commun. 3:740 doi: 10.1038/ncomms1732.
[27] Kinoshita T & Seki M (2014) Epigenetic Memory for Stress Response and Adaptation in Plants. Plant Cell Physiology 55, 1859–1863. doi:10.1093/pcp/pcu125.
[28] Choudhury FK, Rivero RM, Blumwald E & Mittler R (2017). Reactive oxygen species, abiotic stress and stress combination. Plant Journal, 90, 856-867. doi: 10.1111/tpj.13299.
[29] Lakra N, Nutan KK, Singla-Pareek SL & Pareek A (2013). Modulating the expression of transcription factors: an attractive strategy for raising abiotic stress tolerant plants. Plant Stress, 7, 84-99.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : DIZENGREMEL Pierre (5 juin 2023), Contraintes environnementales et stress oxydant chez les plantes, Encyclopédie de l’Environnement. Consulté le 27 mars 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/contraintes-environnementales-stress-oxydant-plantes/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







