Paysages alluviaux alpins et biodiversité
PDF
Les communautés végétales riveraines des cours d’eau matérialisent des habitats spécifiques, à la limite terre-eau, où interagissent les flux d’eau, de sédiments et d’énergie et la végétation elle-même. La dynamique fluviale est à l’origine de processus écologiques et hydromorphologiques responsables de la forte variabilité spatio-temporelle des facteurs du milieu. La biodiversité varie longitudinalement de la source à l’embouchure et transversalement, des zones de pleine eau aux arrières marais inondés périodiquement par les crues. Elle est aussi étroitement dépendante des écoulements souterrains. Les cours d’eau étant très réactifs aux changements climatiques et aux activités humaines qui affectent les bassins versants, la plupart des rivières ont été régulées artificiellement au cours des deux derniers siècles. Il en a résulté une forte érosion de la biodiversité dont la restauration et la gestion passent aujourd’hui par la recherche d’une dynamique fluviale soutenable et garantissant le renouvellement régulier des habitats rivulaires.
1. Des plantes adaptées aux crues
Les communautés végétales alluviales matérialisent des zones de transition entre milieux aquatiques et terrestres remodelées en permanence par l’activité des cours d’eau [1]. Sous la pression des contraintes imposées, les plantes ont développé des réponses adaptatives leur permettant de s’installer, de se développer et de se reproduire dans ces habitats soumis à l’influence des flux d’eau, d’énergie et de matériaux [2]. Les réponses adaptatives s’expriment par :
- des systèmes racinaires très développés qui fixent efficacement les dépôts et résistent à l’érosion et au courant ;
- une facilité à régénérer à partir des tiges et branches enfouies dans les sédiments ;
- une faculté à coloniser rapidement les milieux favorables par reproduction végétative (rhizomes) et par dispersion de graines nombreuses par l’eau et le vent.
- des adaptations physiologiques permettant de supporter des périodes d’anoxie prolongées.
Les plantes résistent ainsi au stress imposé par les crues dont la fréquence, l’intensité, l’étendue et le moment de l’année biologique où elles surviennent ont une forte variabilité. La capacité du cours d’eau à créer des milieux neufs par la dynamique fluviale explique la forte biodiversité car des habitats variés sont alors mis à disposition. Les plantes qu’on y trouve, comme les saules et peupliers par exemple, sont étroitement dépendantes de la perturbation pour leur dissémination et leur reproduction. Le développement des végétaux après germination est lié à la présence de dépôts exondés et stables sur des périodes allant de l’année biologique pour les espèces pionnières annuelles, au siècle pour les espèces pérennes de la forêt alluviale mature de bois dur.
2. Organisation spatio-temporelle du paysage végétal



Verticalement. Diverses espèces et communautés souterraines ou terrestres dépendent des sous-écoulements et du niveau de profondeur des nappes temporaires ainsi que des variations de la nappe phréatique permanente (Figure 4).
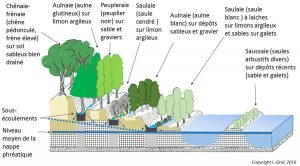
3. Processus écologiques et hydromorphologiques
La succession. Sur les dépôts stabilisés, la végétation change au cours du temps. Les plantes installées font place à de nouvelles arrivantes qui entrent en compétition pour l’acquisition des ressources. La composition des groupements végétaux -et donc la biodiversité- changent depuis des stades herbacés, puis arbustifs et arborescents à bois tendre jusqu’à des stades forestiers à bois dur (Figure 5). Cette évolution est expliquée par des changements de conditions écologiques internes et contrôlés par la communauté végétale (succession autogénique) ou créés par des facteurs externes. Dans ce dernier modèle, appelé succession allogénique, -le plus courant le long des cours d’eau dynamiques- les crues déposent des alluvions qui favorisent l’installation de nouvelles espèces. Dans ce cas, une succession allogénique par facilitation est initiée ; elle se traduit par une augmentation de la biodiversité au cours des stades transitoires. Le stade terminal de la forêt mature de bois dur évolue ensuite par des processus autogéniques lents qui agissent au niveau des sols avec la participation de champignons et de bactéries (Figure 5).



4. Influence humaine sur la longue durée

XIXe siècle : modifications de la structure du paysage alluvial. Au XIXe siècle, les rivières en tresses ont été endiguées puis on a contrôlé les flux (eau et sédiments) par des travaux de dérivation, de colmatage artificiel et de drainage qui modifièrent l’espace alluvial hors-digue [9].

XXe siècle : érosion de la biodiversité. Sur les bassins versants, la diminution des précipitations et la végétalisation des terrains dénudés ont des incidences sur la dynamique fluviale dès le début du XXe siècle. Un ruissellement amoindri sur des pentes stabilisées limite l’érosion ; en outre, une grande partie des sédiments est stockée à l’amont dans les réservoirs hydroélectriques. Il en résulte un déficit en charge grossière qui se traduit par un enfoncement des lits, accentué par les extractions de granulats en rivière. On note alors une stabilisation des dépôts latéraux. Les crues annuelles, écrêtées par les barrages, ne sont plus suffisantes pour mobiliser la charge de fond pouvant renouveler les formes hydromorphologiques. En revanche, des crues décennales survenant en période végétative créent des rehaussements spectaculaires, renforçant la stabilité des atterrissements. Il en résulte une perte de biodiversité par homogénéisation de la végétation aux stades forestiers de fin de succession. Les plantes de début de succession comme la petite massette, liées aux cours d’eau dynamiques sont menacées de disparition. Il en est de même pour les saules (six espèces présentes), pour la myricaire, l’argousier, le peuplier noir et l’aulne blanc, arbre typique du piedmont alpin. Les communautés alluviales à structure hétérogène, composées d’espèces indigènes à auto-régénération naturelle, cèdent la place à des communautés homogènes, stables et fortement imprégnées d’espèces exotiques.
XXIe siècle : redynamiser les cours d’eau. Le boisement des bancs alluviaux réduit la capacité du chenal endigué qui n’est plus en mesure d’assurer le transit lors des crues exceptionnelles. La protection des plaines alluviales très anthropisées passe par des aménagements adaptés. Où cela est possible on pourra élargir l’espace de liberté de la rivière ou créer, hors digue, des bassins de rétention dans des zones réservées à la forêt alluviale, aux peupleraies ou aux prairies et marais. Cependant, le déboisement et l’arasement des îlots reste une étape nécessaire pour assurer la sécurité des hommes et des biens ainsi que la conservation de la biodiversité. A l’intérieur du chenal, la richesse biologique dépend effectivement de la création d’espaces nus où débuteront les phases initiales de la succession végétale. Les grands arbres pouvant générer des embâcles y sont par contre proscrits.

5. État de référence pour la restauration de la biodiversité
Climat, colonisations alpines et développement du tressage. Dans le cas des rivières alpines, on a montré une forte augmentation en volume de matériaux grossiers transportés à l’Age du Fer (2700/2400 BP), à l’époque post-romaine (500-700 AD) et au Petit Age Glaciaire (1550-1850). Avec l’augmentation de la pluviosité, les activités humaines, telles que le déboisement et le développement de l’agriculture sur les versants en furent les principaux responsables. Ces changements furent alors à l’origine du processus de tressage prouvé par les paléochenaux inscrits dans les niveaux datés de ces époques [14].
Cartes anciennes et représentation d’un état de référence. Les cours d’eau de piedmont ont présenté au cours du Petit Âge Glaciaire toute la variété d’habitats (soit une quarantaine de communautés végétales) liée au « système en tresses avec îles végétalisées ». Cette diversité représentée par les cartes des XVIIIe et XIXe siècles (voir Figure 8 et [9]) prête au système en tresses les caractéristiques du modèle de référence [15] pour la renaturation des plaines alluviales alpines. Revenir à un état naturel est ici très discutable car plusieurs communautés à forte biodiversité résultent de l’exploitation des végétaux par l’homme [16]. De plus, pour des raisons socio-économiques, retrouver le paysage antérieur à l’endiguement relève de l’utopie.

Avenir de la biodiversité alluviale alpine. Un des enjeux majeurs liés au réchauffement climatique sera celui de la gestion des eaux et de ses impacts sur l’écologie fluviale. Si la politique de renaturation des plaines alluviales par l’augmentation des débits réservés [12] n’était pas poursuivie, il faudrait alors s’attendre à un changement important dans l’organisation spatiale et la biodiversité des paysages végétaux alluviaux.
Références et notes
Photo de couverture : Végétation d’un cours d’eau en tresses : le Tagliamento, Italie [Source : J. Girel]
[1] Concept de renouvellement permanent des habitats dans la mosaïque (Shifting Habitat Mosaïc = SHM) ; Stanford J.A., Lorang M.S. & Hauer F.R. (2005) The shifting habitat mosaic of river ecosystems. Verhandlungen der Internationalen Vereinigung für theoretische und Angewandte Limnologie, 29, 123-136.
[2] Hauer F.R., Locke H., Dreitz V.J., Hebblewhite M., Lowe W.H., Muhlfeld C.C., Nelson C.R., Proctor M.F. & Rood S.B. (2016) Gravel-bed river floodplains are the ecological nexus of glaciated mountain landscapes. Science Advances, 2(6), 1-13.
[3] Hypothèse de la perturbation intermédiaire (Intermediate disturbance hypothesis) ; Wilkinson D.M. (1999) The Disturbing History of Intermediate Disturbance. Oikos 84(1), 145–147.
[4] Concept de continuum fluvial (River Continuum Concept = RRC) ; Vannote R.L., Minshall G.W. & Cummins K.W. (1980) The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences, 37, 130-137.
[5] Prunier P., Bonin L. & Frossard P.-A. (2013) Guide des espèces in: Interreg France-Suisse, Programme “GeniAlp” Génie végétal en rivière de montagne, 318 pages.
[6] Concept de connectivités latérales de crues (Flood Pulse Concept = FPC) ; Junk W.J., Bayley P.B. & Sparks R.E. (1989) The flood-pulse concept in river-floodplain systems. Canadian Special Publication of Fisheries and Aquatic Sciences, 106, 110-127.
[7] Bravard J.-P. (2016) La longue durée des métamorphoses fluviales, in Bethemont J. & Bravard J.-P. « Pour saluer le Rhône », Ed. Libel, Lyon, 50-61
[8] Beechie T.J., Liermann M., Pollock M.M., Baker S. & Davies J.R.(2006) Channel pattern and river-floodplain dynamics in forested mountain river systems. Geomorphology, 78(1-2):124-141.
[9] Girel J. (2016) La vallée de l’Isère entre Albertville et Grenoble : un paysage alluvial lié aux aménagements hydrauliques du XIXe siècle et à leurs impacts. in : P. Fournier & G. Massard-Guilbaud, (Dir), Aménagement et Environnement, Perspectives historiques, Collection « Histoire », Presses Universitaires de Rennes, 149-161.
[10] Girel J., Garguet-Duport B. & Pautou G. (1997) Present structure and construction processes of landscapes in Alpine floodplains. A case study: the Arc-Isère confluence (Savoie, France). Environmental Management, 21(6), 891-907.
[11] Girel J. (2010) Histoire de l’endiguement de l’Isère en Savoie : conséquences sur l’organisation du paysage et la biodiversité actuelle. Géocarrefour, 85(1), 2010, p. 41-54.
[12] Débit d’eau minimal obligatoire (exprimé en pourcentage du débit total moyen) que les gestionnaires d’un ouvrage hydraulique (barrage, seuil, unité hydroélectrique…) doivent réserver au cours d’eau et au fonctionnement minimal des écosystèmes.
[13] Merritt D.M., Scott M.L., Leroy-Poff N., Auble G.T. & Lytle D.A. (2010) Theory, methods and tools for determining environmental flows for riparian vegetation: riparian vegetation-flow response guilds. Freshwater Biology, 55(1), 206-225.
[14] Salvador P.-G. (1991) La métamorphose des cours du Drac et de l’Isère à l’époque moderne dans la région grenobloise (Isère, France). Physio.-Géo. (Paris), 22/23, 173-178.
[15] Ward J.V., Tockner K., Edwards P.J., Kollmann J., Bretschko G., Gurnell A., Petts G.E. & Rossaro B. (1999) A reference river system for the Alps: the “Fiume Tagliamento”. Regulated Rivers: Research & management, 15, 63-75.
[16] Girel J. (2011) Les communaux dans une vallée alpine au XIXe siècle : Impacts de l’endiguement sur le statut, la productivité et les usages des délaissés alluviaux (exemple de l’Isère dans la Combe de Savoie) in: C. Beck, J.-M. Derex & B. Sajaloli (eds), Usages et espaces communautaires dans les zones humides, Collection Journées d’études, GHZH, P. de Maisonneuve, Vincennes, 89-106. http://ghzh.free.fr/.
[17] Galat D.L., Fredrickson L.H., Humburg D.D., Bataille K.J., Bodie J.R., Dohrenwend J. et al. (1998) Flooding to restore connectivity of regulated large-river wetlands. BioScience, 48, 721-733. Selon le concept de “restauration en chapelet” (String-of-Beads Restauration Concept) exposé dans cet article, des zones alluviales élargies se succédant (comme des perles dans un collier, permettent le bon fonctionnement des processus hydrogéomorphologiques et écologiques à l’origine de la biodiversité.
[18] Till-Bottraud I., Poncet B.-N., Rioux D. & Girel J. (2010) Spatial structure and clonal distribution of genotypes in the rare Typha minima Hoppe (Typhaceae) along a river system. Botanica Helvetica, 120, 53-62.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : GIREL Jacky (24 mars 2018), Paysages alluviaux alpins et biodiversité, Encyclopédie de l’Environnement. Consulté le 2 avril 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/paysages-alluviaux-alpins-biodiversite/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







