Restaurer les savanes et les écosystèmes herbacés tropicaux
PDF
Lorsqu’on évoque la savane, chacun pense aux vastes paysages africains où déambulent éléphants, gnous, girafes ou lions. Au gré des saisons et des pluies, la végétation -des herbes hautes plus ou moins parsemées d’arbres et d’arbustes- passe du vert au jaune. Ces écosystèmes herbacés couvrent environ 20 % de la surface terrestre et sont présents sur toute la ceinture tropicale du globe, en Afrique bien sûr, mais aussi en Amérique ou encore en Asie. Les feux récurrents ou les herbivores, eux-mêmes contrôlés par les prédateurs, permettent de maintenir ces milieux ouverts en limitant la présence d’arbres et d’arbustes. En raison de la complexité de la dynamique de la végétation des savanes, les impacts du changement climatique et de l’utilisation des terres sur les savanes sont très incertains. Mais dès à présent, les savanes sont largement menacées par les activités humaines : conversion des terres pour l’agriculture, urbanisation, etc. Elles le sont aussi par la plantation massive d’arbres souvent réalisée dans le cadre de compensation carbone. La résilience naturelle de ces écosystèmes face aux dégradations d’origine anthropique est faible et des actions de restauration sont souvent nécessaires, mais restent un défi permanent.
1. Les écosystèmes herbacés primaires tropicaux
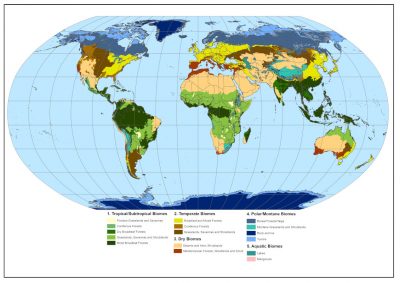

- En Afrique, dans la zone sub-saharienne, dans la grande région de l’Afrique de l’Est, en Afrique centrale et jusqu’en Afrique du Sud (Figure 2) ;
- En Amérique du sud et centrale (Figure 3), principalement au centre du continent, dans une région que l’on appelle localement Cerrado, mais également au Vénézuela et en Colombie où les savanes répondent au nom de Llanos. Elles existent également au milieu de la forêt amazonienne et en Guyane ;
- Au nord de l’Australie et au sud de la nouvelle Guinée ;
- En Asie, notamment en Inde et en Chine, où elles sont moins connues et couvrent de moindres surfaces.

2. Organisation d’une savane
2.1. Origine de la structuration d’une savane
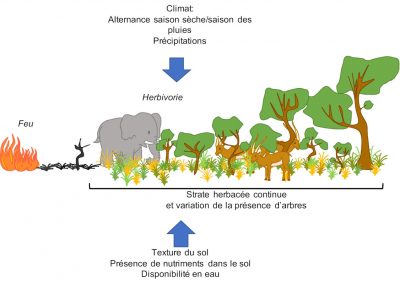
Alors que les arbres sont souvent résistants* ou résilients* au feu, les espèces composant la strate herbacée sont, elles, généralement intolérantes à l’ombre [2]. Cette coexistence est assez inhabituelle. C’est l’interaction de plusieurs processus en relation avec l’utilisation de l’eau, les propriétés du sol et les régimes de perturbations* -comme le feu- qui est à l’origine de la structure de la végétation de ces écosystèmes [2],[3] :
- Le climat (quantité de précipitations et durée de la saison des pluies entre autres), parce qu’il faut un minimum de précipitations pour permettre qu’une végétation arborée s’établisse [4],[5],[6]. Les régions tropicales sont marquées par une forte saisonnalité avec l’alternance d’une saison sèche et d’une saison humide [4],[6]. De nombreuses zones tropicales sont occupées par les savanes -des écosystèmes ouverts- [2],[5],[7] alors qu’on pourrait s’attendre à observer des forêts du fait de la quantité de précipitations.
- Les perturbations chroniques, notamment les feux et l’herbivorie, limitent le couvert ligneux, et donc le maintien de la savane (Figure 5).
- Les caractéristiques du sol, telles que sa composition et sa texture : un sol sableux -présentant une plus faible rétention d’eau- aura tendance à supporter plus d’arbustes alors qu’un sol argileux -retenant plus d’eau- aura une végétation plus herbacée (voir Figure 2).

2.2. Le feu, un acteur majeur de la savane
La distribution des savanes ne peut donc être prédite uniquement par le climat. Ainsi, des perturbations telles que l’herbivorie (celle notamment des « méga-herbivores », tels qu’éléphants et ongulés) et le feu jouent un rôle écologique et évolutif prépondérant pour les savanes [2],[5],[9] (voir Figures 2 à 5).
Dans la strate herbacée, les graminées sont un biocombustible majeur. Leur présence favorise les feux, limitant la pousse des arbres et arbustes. Le cycle de vie des graminées, et des espèces herbacées en général, est bien adapté aux feux : elles sont capables de repousser et de se reproduire très rapidement suite à un feu (Figure 6). Leur présence dans ces écosystèmes dépend donc de la récurrence des feux.

- Les espèces de savane présentent des traits en relation avec la résistance au feu, en particulier une écorce épaisse, comme Curatella americana L. (Dilleniaceae), Caryocar brasiliense (Caryocraceae), Handroanthus ochraceus (Bignoniaceae), Pterodon emarginatus (Fabaceae), Bowdichia virgilioides (Fabaceae), Annona crassiflora (Annonaceae) que l’on trouve dans le Cerrado et le Llanos ;
- Les espèces de forêts ont des écorces bien plus fines, les rendant vulnérables au feu comme Copaifera langsdorffii (Fabaceae), Swartzia flaemingii (Fabaceae), Hymenaea coubaril (Fabaceae), Cariniana estrellensis (Lecythidaceae), Xylopia aromatica (Annonaceae).
Dans les régions tropicales, de nombreuses savanes seraient des forêts sans la présence de ces perturbations [11], car la quantité de précipitations est suffisante pour permettre l’occurrence de forêts. Dans ces régions, forêts et savanes sont considérées alors comme des états alternatifs de biome* [5],[7]. Les conditions environnementales permettent la présence soit de la forêt, soit de la savane, et la présence de l’un ou de l’autre état sera donc principalement définie par l’occurrence de perturbations, leur intensité et leur fréquence.
3. Biodiversité et problèmes de conservation
Les savanes représentent un patrimoine exceptionnel. Ce sont des écosystèmes extrêmement riches en biodiversité et notamment en espèces endémiques. A titre d’exemple, la savane brésilienne appelée Cerrado, qui s’étend sur deux millions de km², comporte plus de 12 000 espèces végétales. C’est la savane la plus riche en espèces à l’échelle mondiale (Lire Focus Le biome Cerrado).
Les savanes africaines, en plus de leur richesse végétale, abritent une mégafaune emblématique. Les éléphants, zèbres, girafes, lions et guépards sont mieux adaptés à ces écosystèmes ouverts. Les savanes font également partie de notre patrimoine culturel et de notre histoire. Ainsi certaines études ont montré que les humains ont une préférence innée pour les paysages ouverts, qui pourrait provenir de notre longue histoire évolutive dans les savanes d’Afrique de l’est. Ces milieux sont souvent considérés comme un des moteurs de l’évolution humaine.
Cependant les activités humaines, si elles n’en sont pas à l’origine, ont, au fil du temps, profondément impactées les régimes de feu et l’herbivorie et de fait la distribution des savanes [12]. Aujourd’hui encore beaucoup de populations vivent au cœur de ces écosystèmes et dépendent des services qu’ils fournissent, entre autres le contrôle de la qualité de l’eau, la possibilité de pâturage, la présence de gibier.
Malgré le patrimoine culturel et naturel qu’ils représentent, les écosystèmes herbacés tropicaux sont largement menacés par la conversion de grandes surfaces pour l’agriculture, par des politiques de suppression des feux, et par la plantation d’arbres dans un but commercial ou parfois dans un contexte de compensation des émissions carbone. Le Cerrado par exemple enregistre un taux de conversion en terres agricoles bien supérieur aux taux de conversion enregistrés en forêt amazonienne [13],[14].
4. La résilience des savanes

Bien que les feux dans les savanes soient à l’origine naturels (éclairs durant les orages), les régimes de feux ont depuis longtemps été influencés par les activités humaines (au moins 300 000 ans en Afrique). L’évolution humaine est liée à une augmentation des surfaces brûlées [12]. L’impact substantiel des activités humaines sur les régimes de feux semble cependant être plus récent et pourrait remonter à environ 4000 ans. La mise en place du pastoralisme s’est accompagnée d’une diminution de la surface de terres brûlées : le pâturage par le bétail ayant réduit la quantité de biocombustible disponible [12].
La mise à disposition des nutriments sous forme de cendre, la présence de bourgeons souterrains, la protection des bourgeons sous une écorce épaisse ou encore la présence d’importants organes souterrains pour le stockage des nutriments, permettent à la végétation, que ce soit les espèces ligneuses ou herbacées, de repousser très rapidement après un feu [5] (Figure 7).
En revanche, au cours des dernières décennies, les activités humaines ont largement modifié les régimes de feux, leur fréquence et leur intensité, augmentant globalement les surfaces brûlées, et modifiant la taille des surfaces brûlées bien qu’on observe des différences régionales [12]. De nombreux gouvernements (au Brésil, Botswana, Zimbabwe, Afrique du Sud par exemple) ont mis en place des programmes de prévention et d’exclusion des feux : tous les feux doivent être systématiquement combattus et éteints lorsque cela est possible.
La dégradation et la conversion des savanes peuvent être très rapides et bien souvent peu réversibles. Les processus de dégradation sont variables, que ce soit l’introduction d’espèces exotiques invasives, l’introduction de bétail, l’exclusion des feux, la densification du couvert arboré ou encore la plantation d’arbres dans des milieux ouverts. Le niveau de dégradation dépend bien évidement de la durée et de l’intensité de la dégradation. Lorsque les perturbations sont plus intenses, ou en cas de modifications majeures du milieu comme l’afforestation, la conversion en terres agricoles ou les activités minières, les modifications de la végétation et du sol sont tellement importantes que la résilience naturelle est réduite voire inexistante [15].
Bien souvent, le seuil de dégradation au-delà duquel le rétablissement spontané des savanes est impossible (ou sera très long) est rapidement dépassé :
- Les processus d’assemblage des communautés sont lents et dépendants de nombreuses interactions ;
- La dispersion des graines est souvent limitée.
Les actions de restauration actives sont essentielles dans ces cas-là.
5. Restauration des écosystèmes herbacés tropicaux

Une première étape est la prise en compte des perturbations naturelles occasionnées par les feux et par les grands herbivores. Ainsi les techniques de restauration des savanes comprennent notamment la réintroduction des perturbations naturelles comme l’utilisation de brûlages dirigés, la gestion du pâturage, la réintroduction des herbivores, mais aussi l’élimination des espèces invasives.
En cas de dégradations majeures (Figure 8), il faut également pouvoir restaurer la géomorphologie et les propriétés du sol, puis réintroduire les espèces autochtones, ce qui peut être compliqué pour la plupart des espèces herbacées dont l’écologie et la biologie sont peu documentées. Par exemple certaines espèces :
- produisent peu ou pas de graines, ou n’ont pas une reproduction régulière ;
- dépendent du feu pour se reproduire sexuellement ou présentent une dormance qui doit être levée [16].
Bien que la restauration de la strate herbacée soit fondamentale pour restaurer les processus écologiques de ces écosystèmes, elle s’avère bien souvent, infructueuse, souvent limitée par :
- la colonisation et la compétition avec des espèces invasives ;
- le fait que les graines d’espèces herbacées autochtones ne soient pas disponibles et/ou que leur propagation ne soit pas efficace [15].
6. Afforestation
Un autre problème à la restauration des savanes, est qu’elles sont souvent mal considérées. Leur biodiversité et l’importance des services (écosystémiques) qu’elles rendent aux sociétés ne sont pas toujours perçues par le grand public et les décideurs, y compris par les entités gouvernementales qui pourraient mettre en place des programmes de conservation.
Souvent à tort, les savanes sont considérées comme des forêts dégradées, ce qui complique les perceptions concernant ces écosystèmes et qui justifie les programmes d’exclusion des feux.
Ainsi de nombreux projets de « restauration » de savanes consistent à planter des arbres. La plantation massive d’arbres n’est pas une technique de restauration appropriée pour les savanes, spécialement parce que les espèces herbacées, notamment les graminées en C4, sont généralement inadaptées à l’ombre. La régénération spontanée de la strate herbacée sera largement compromise, pour ne pas dire impossible, en présence d’un couvert arboré important.
En conséquence le retour à des régimes de feux proches des régimes naturels, la présence d’herbivores et les processus qui en découlent, seront également compromis en l’absence de biomasse herbacée (source de nourriture pour les herbivores et combustible). Rétablir la strate herbacée doit être une priorité pour restaurer ces écosystèmes.
Lancé en 2011, le « Défi de Bonn [17] » a pour objectif de restaurer 150 millions d’hectares de terres dégradées et déboisées d’ici à 2020, et 350 millions d’hectares d’ici à 2030. Dans ce contexte, plusieurs initiatives ont émergé pour promouvoir le reboisement et la plantation d’arbres à large échelle, en tant que solution au changement climatique ; les arbres absorbant durant leur croissance et conservant une grande partie du CO2 émis par les activités humaines. Plusieurs initiatives ont mis en avant des zones potentielles de restauration de forêts [18],[19]. Dans certains cas, la plantation d’arbres peut avoir un objectif pratique comme la lutte contrer les effets néfastes de la désertification et bloquer l’avancée du désert (Lire La Grande Muraille Verte : un espoir pour reverdir le Sahel ?). Dans ce cas spécifique, la végétation arborée fournit des services écosystémiques essentiels puisqu’elle participe à la lutte contre la désertification et parce que la population locale dépend fortement de la biodiversité ligneuse. Si l’on peut saluer l’existence de tels projets lorsqu’il s’agit de restaurer des forêts dégradées, ou répondre à des objectifs pratiques de lutte contre la désertification, il faut aussi avertir du risque d’afforester des zones où l’on avait auparavant des savanes et autres pelouses tropicales.
Plusieurs études ont déjà pointé le risque lié à la plantation d’arbres dans des écosystèmes dits « ouverts » (même si le couvert arboré peut être assez important), tels que les savanes où la strate herbacée est primordiale et dominée par des espèces intolérantes à l’ombre [1],[5].
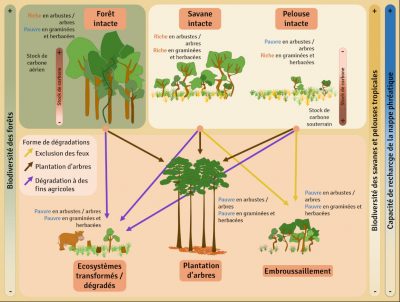
Il est très important de distinguer d’une part les savanes d’origine naturelle qui sont riches en espèces et doivent être conservées et d’autre part les forêts dégradées, parfois appelées à tort « savanes » ou encore dérivé de savanes (en anglais : derived savanna), qui sont pauvres en espèces et peuvent restaurées en forêt [21].
En outre, si l’argument majeur pour planter des arbres est qu’il s’agit d’une des meilleures solutions pour lutter contre le changement climatique, il est également important de rappeler que dans les savanes la majorité de la biomasse est souterraine, représentant environ 70% de la biomasse totale. Les stocks de carbone localisés sous terre sont donc loin d’être négligeables, particulièrement bien protégés des feux, et stables.
Outre la perte de la biodiversité animale et végétale liée à l’afforestation de ces écosystèmes ouverts [22], les dommages sont également mesurables au niveau économique, spécialement pour certaines populations dont l’activité repose sur les savanes que ce soit pour le pâturage, l’approvisionnement en gibier ou la sécurité de certains services écosystémiques, notamment l’approvisionnement et la qualité de l’eau. En plus de la perte de biodiversité, d’habitats pour de nombreuses espèces animales et la dégradation de nombreux services écosystémiques, préconiser la plantation massive d’arbres dans des écosystèmes sujets au feu conduit à augmenter les risques de feux massifs et au final la perte du carbone stocké (Figure 9).
7. Savanes & changement climatique : des projections contrastées
Déjà très largement affectés par les changements d’usage des terres d’origine anthropique, les savanes devraient être profondément modifiées par le changement climatique et l’augmentation des concentrations de CO2 dans l’atmosphère.[23] En effet, l’étendue des savanes dépend de la quantité de précipitations et de la saisonnalité du climat. Pour le futur, des projections contrastées sont données par les différentes approches de modélisation.[24] D’une manière générale, les changements climatiques tendent vers une réduction de l’étendue des savanes à l’échelle globale, selon deux mécanismes différents :
- Dans les régions où une réduction des précipitations est prévue, il existe un risque de désertification. Parce que les deux types de végétation qui structurent les savanes – les arbres C3 et les herbes C4 – réagissent différemment aux mêmes contrôles environnementaux,[25] les réactions des savanes aux sécheresses peuvent donc être différentes de celles des forêts et des prairies [26]. De plus, une augmentation des sécheresses peut limiter la présence des arbres tout en favorisant les incendies dans des écosystèmes, comme les forêts, non adaptés au feu.
- Dans d’autres régions, une augmentation des précipitations est attendue ce qui engendrerait une densification du couvert arboré et arbustif (embroussaillement) au détriment des savanes. Ce processus est déjà en cours dû à l’augmentation du CO2 atmosphérique. [27] Dans certaines régions, une réduction de la végétation herbacée peut avoir des conséquences graves sur l’économie locale si celle-ci dépend de l’élevage et du pâturage par exemple.
Par exemple, le changement climatique entraînera une érosion généralisée des différences entre les communautés écologiques du biome Cerrado [28], l’un des principaux facteurs de perte de biodiversité et de services écosystémiques.
8. Messages à retenir
- La restauration des forêts dégradées, notamment en replantant des arbres, est essentielle, mais la plantation d’arbres ne doit pas compromettre la conservation et la restauration d’autres écosystèmes.
- La restauration écologique doit permettre de rétablir les écosystèmes dégradés, mais en aucun cas de détruire des écosystèmes naturels.
- Puisque la restauration des savanes reste difficile, les politiques environnementales devraient donner la priorité à leur conservation.
- La valorisation de la biodiversité et la reconnaissance des services écosystémiques que ces écosystèmes fournissent est un premier pas pour améliorer leur conservation, en parallèle de la gestion des zones naturelles. Ceci implique l’utilisation de brûlages dirigés, la présence de feux naturels et/ou de l’herbivorie par la mégafaune autochtone.
Cet article est une version modifiée du ‘regard’ R90 de Soizig Le Stradic et Elise Buisson, édité par la Société Française d’Ecologie et Evolution (SFE2) et mis en ligne sur son site web en février 2020.
Notes et références
Image de couverture. Photo © S. Le Stradig
[1] Veldman, J.W., Buisson, E., Durigan, G., Fernandes, G.W., Le Stradic, S., Mahy, G., Negreiros, D., Overbeck, G.E., Veldman, R.G., Zaloumis, N.P., Putz, F.E., & Bond, W.J. 2015. Toward an old-growth concept for grasslands, savannas, and woodlands. Frontiers in Ecology and the Environment 13:154–162.
[2] Pausas, J.G., & Bond, W.J. 2020. Alternative Biome States in Terrestrial Ecosystems. Trends in Plant Science. doi: 10.1016/j.tplants.2019.11.003.
[3] Hoffmann, W.A. 1998. Fire and population dynamics of woody plants in a neotropical savanna: matrix model projections. Ecology 80:1354–1369.
[4] Sankaran, M., Hanan, N.P., Scholes, R.J., Ratnam, J., Augustine, D.J., Cade, B.S., Gignoux, J., Higgins, S.I., Le Roux, X., Ludwig, F., Ardo, J., Banyikwa, F., Bronn, A., Bucini, G., Caylor, K.K., Coughenour, M.B., Diouf, A., Ekaya, W., Feral, C.J., February, E.C., Frost, P.G.H., Hiernaux, P., Hrabar, H., Metzger, K.L., Prins, H.H.T., Ringrose, S., Sea, W., Tews, J., Worden, J., & Zambatis, N. 2005. Determinants of woody cover in African savannas. Nature 438:846–849.
[5] Staver, A.C., Archibald, S., & Levin, S.A. 2011. The global extent and determinants of savanna and forest as alternative biome states. Science 334:230–232.
[6] Lehmann, C.E.R., Anderson, T.M., Sankaran, M., Higgins, S.I., Archibald, S., Hoffmann, W.A., Hanan, N.P., Williams, R.J., Fensham, R.J., Felfili, J., Hutley, L.B., Ratnam, J., San Jose, J., Montes, R., Franklin, D., Russell-Smith, J., Ryan, C.M., Durigan, G., Hiernaux, P., Haidar, R., Bowman, D.M.J.S., & Bond, W.J. 2014. Savanna vegetation-fire-climate relationships differ among continents. Science 343:548–552.
[7] Dantas, V. de L., Hirota, M., Oliveira, R.S., & Pausas, J.G. 2016. Disturbance maintains alternative biome states (M. Rejmanek, Ed.). Ecology Letters 19: 12–19.
[8] Vasconcelos, T.N.C., Alcantara, S., Andrino, C.O., Forest, F., Reginato, M., Simon, M.F., & Pirani, J.R. 2020. Fast diversification through a mosaic of evolutionary histories characterizes the endemic flora of ancient Neotropical mountains. Proceedings of the Royal Society B: Biological Sciences 287:2019-2933.
[9] Simon, M.F., Grether, R., Queiroz, L.P. De, Skema, C., Pennington, R.T., & Hughes, C.E. 2009. Recent assembly of the Cerrado, a neotropical plant diversity hotspot, by in situ evolution of adaptations to fire. Proceedings of the National Academy of Sciences of the United States of America 106:20359–20364.
[10] Charles-Dominique, T., Beckett, H., Midgley, G.F., & Bond, W.J. 2015. Bud protection: a key trait for species sorting in a forest-savanna mosaic. New phytologist. doi: 10.1111/nph.13406 ; Charles-Dominique, T., Midgley, G.F., & Bond, W.J. 2017. Fire frequency filters species by bark traits in a savanna-forest mosaic (S. Scheiner, Ed.). Journal of Vegetation Science 28:728–735.
[11] Bond, W.J., Woodward, F.I., & Midgley, G.F. 2004. The global distribution of ecosystems in a world without fire. New Phytologist 165:525–538.
[12] Archibald, S., Lehmann, C.E.R., Gomez-Dans, J.L., & Bradstock, R.A. 2013. Defining pyromes and global syndromes of fire regimes. Proceedings of the National Academy of Sciences 110:6442–6447.
[13] Beuchle, R., Grecchi, R.C., Shimabukuro, Y.E., Seliger, R., Eva, H.D., Sano, E., & Achard, F. 2015. Land cover changes in the Brazilian Cerrado and Caatinga biomes from 1990 to 2010 based on a systematic remote sensing sampling approach. Applied Geography 58:116–127.
[14] Overbeck, G.E., Müller, S.C., Fidelis, A., Pfadenhauer, J. Pillar, V.D., Blanco, C.C., Boldrini, I.I., Both, R., & Forneck, E. (2007). Brazil’s neglected biome: The South Brazilian Campos. Perspectives in Plant Ecology, Evolution and Systematics. 9:101-116. 10.1016/j.ppees.2007.07.005.
[15] Buisson, E., Le Stradic, S., Silveira, F.A.O., Durigan, G., Overbeck, G.E., Fidelis, A., Fernandes, G.W., Bond, W.J., Hermann, J., Mahy, G., Alvarado, S.T., Zaloumis, N.P., & Veldman, J.W. 2019. Resilience and restoration of tropical and subtropical grasslands, savannas, and grassy woodlands. Biological Reviews 94:590–609.
[16] Dayrell, R.L.C., Garcia, Q.S., Negreiros, D., Baskin, C.C., Baskin, J.M., & Silveira, F.A.O. 2017. Phylogeny strongly drives seed dormancy and quality in a climatically buffered hotspot for plant endemism. Annals of Botany 119:267–277.
[17] Le défi de Bonn est un effort mondial visant à remettre en état 150 millions d’hectares de terres déboisées et dégradées dans le monde d’ici 2020, et 350 millions d’hectares d’ici 2030. Il a été lancé en 2011 par le gouvernement allemand et l’UICN, puis approuvé et prolongé par la Déclaration de New York sur les forêts lors du sommet des Nations unies sur le climat de 2014.
[18] Bastin, J.-F., Finegold, Y., Garcia, C., Mollicone, D., Rezende, M., Routh, D., Zohner, C.M., & Crowther, T.W. 2019. The global tree restoration potential. Science 365:76–79.
[19] Forest : sustaining forests for people and planent ; World Resources Institute.
[20] Veldman J.W., Aleman J.C., Alvarado S.T., Anderson T.M., Archibald S. et al., 2019. Comment on “The global tree restoration potential.” Science 366, Issue 6463, eaay7976 ; DOI: 10.1126/science.aay7976
[21] Meli, P., Holl, K.D., Rey Benayas, J.M., Jones, H.P., Jones, P.C., Montoya, D., & Moreno Mateos, D. 2017. A global review of past land use, climate, and active vs. passive restoration effects on forest recovery (S. Joseph, Ed.). PLOS ONE 12.
[22] Abreu, R.C.R., Hoffmann, W.A., Vasconcelos, H.L., Pilon, N.A., Rossatto, D.R., & Durigan, G. 2017. The biodiversity cost of carbon sequestration in tropical savanna. Science Advances 3: e1701284.
[23] Osborne C.P., Charles-Dominique T., Stevens N., Bond W.J., Midgley G. & Lehmann C.E.R. (2018) Human impacts in African savannas are mediated by plant functional traits. New Phytologist 220:10–24.
[24] Moncrieff, G.R., Scheiter, S., Langan L., Trabucco, A. & Higgins, S.I. 2016. The future distribution of the savannah biome: model-based and biogeographic contingency. Phil. Trans. R. Soc. B37120150311
[25] Avec l’augmentation de la concentration en CO2 dans l’atmosphère, les plantes C3 pourraient atteindre des activités photosynthétiques approchant celles des plantes C4 (Lire Le chemin du carbone dans la photosynthèse).
[26] Sankaran M. (2019) Droughts and the ecological future of tropical savanna vegetation. J. Ecol. 107:1531–1549.
[27] O’Connor, T.G., Puttick, J.R. & M Hoffman, M.T. (2014) Bush encroachment in southern Africa: changes and causes, African Journal of Range & Forage Science, 31:2, 67-88, DOI: 10.2989/10220119.2014.939996
[28] Hidasi-Neto, J., Joner, D. C., Resende, F., Monteiro, L. D., Faleiro, F. V., Loyola, R. D., & Cianciaruso, M. V. (2019). Climate change will drive mammal species loss and biotic homogenization in the Cerrado Biodiversity Hotspot. Perspectives in Ecology and Conservation. doi:10.1016/j.pecon.2019.02.001
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : LE STRADIC Soizig, BUISSON Elise (2 juillet 2020), Restaurer les savanes et les écosystèmes herbacés tropicaux, Encyclopédie de l’Environnement. Consulté le 21 janvier 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/restaurer-savanes-ecosystemes-herbaces-tropicaux/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







