细菌生物膜与健康
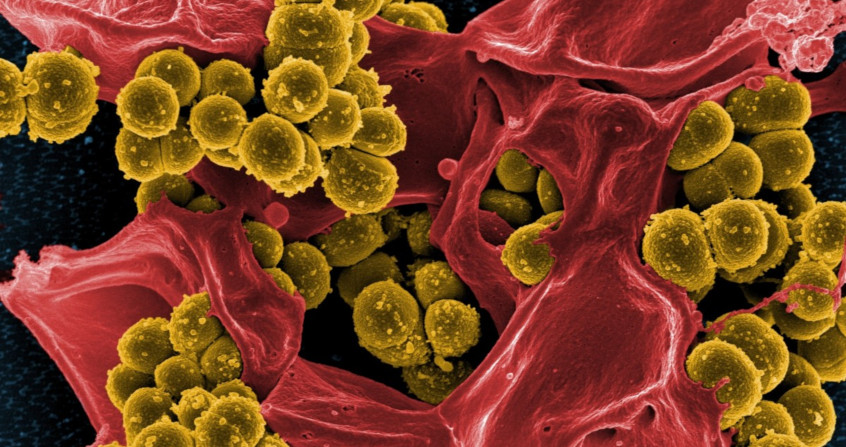
什么是生物膜?它是一种微生物以群体形式生活的方式,使得单细胞生物如细菌能够以群体的方式行事。生物膜通常附着在支撑物上面,而且无处不在。实际上,生物膜是几十亿年前海底生物最初的组织方式之一。大多数细菌感染涉及生物膜,容易导致长期感染,且难以治疗。虽然目前还没有有效的应对策略,但更好地了解这些聚集物的形成和维持机制可以帮助我们在不久的将来开发出新颖、有效的方法。
1. 生物膜或单细胞生物如何组成群落
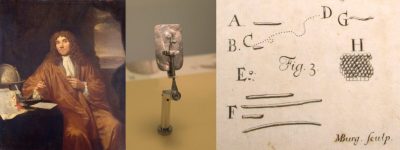
17世纪,荷兰商人安东·范·列文虎克[1]通过他发明的显微镜分析牙菌斑样本(图1)时首次发现了细菌群。他用这种仪器来数编织物中的线纹数量及其厚度。他的主要想法是观察周围环境,是最早使用显微镜探索微生物世界的科学家之一。
但直到20世纪80年代威廉·科斯特顿才使得术语“细菌膜”和“生物膜”得以普及[2]。科斯特顿(1934-2012)是加拿大微生物学家,对水生环境中的细菌尤为感兴趣。与已有数据相反,他指出细菌的主要生存方式是以多细胞生物形式存在的复杂群体,他称之为生物膜。
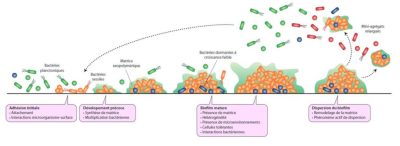
Mini-agrégatsrelargués、Bactéries planctoniques、Matrice exopolymérique、Bactéries sessiles、
Bactéries dormantes à croissance faible、Adhéslon initlale、Attachement、
Interactions microorganisme-surface、Dévelopement précoce 、Synthèse de matrice 、
Multiplication bactérienne、Bloflm mature、Présence de matrice、Hétérogénéité、
Présence de microenvironnements 、Cellules tolérantes、Interaction bactériennes、 Disperslon du bloflm、Remodelage de la matrice、Phénomène actif de dispersion.
传递的微聚体、浮游细菌、基质外聚物、无柄细菌、低生长休眠菌、最初粘附、附着物、微生物-表面相互作用、早期发育、基质合成、细菌繁殖、生物膜成熟、基质存在、异质性、微环境的存在、耐受细胞、细菌相互作用、生物膜分散、基质重塑、主动扩散现象。
生物膜被定义为每克脱水物质所含的多达 1 亿(108 )至 100 亿(1010 )个微生物细胞组成的有序聚集物。在生物膜中,细菌细胞被一种基质所包围,这种基质是由细菌自己产生的,在维持整个群落聚力方面起着主要作用,有时还附着在固体基质上。
大多数细菌都能形成生物膜,一些物种由少数细菌个体形成复杂的异质聚集体的过程已被广泛描述(图 2)。这些步骤之间密切协调,是由基因决定的。
1.1. 生物膜形成的阶段
初始粘附使一些细菌附着在表面;在随后的早期发育阶段,细菌分裂、合成和分泌基质成分(主要是糖、蛋白质和DNA)。基质参与生物膜内细菌的空间组织,确保了复合物的稳定性,并使内部流体循环通道得以形成。因其包含了所有微生物,基质还作为与外部环境的界面,具有保护功能。它也是包括水在内的营养物质的来源,是营养物质(钙,铁等)的储存地和细胞外酶活动的场所。[3]
在接下来的成熟阶段,一个三维结构得以形成,在此异质环境中细菌以竞争或协同的形式进化和相互作用。
最后一步是扩散阶段,一定数量的细菌从生物膜中以独立或微聚集物的形式分离出来,这些微聚集物很可能会在其他生物表面定植。
1.2. 生物膜的特性
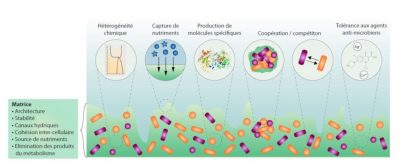
Hétérogénéité chimique、Capture de nutriments、Production de molécules spécifiques、
Coopération/ compétiton、Tolérance aux agentsanti-microbiens、Matrice、Architecture、Stabilité、 Canaux hydriques、Cohésion inter-cellulaire、Source de nutriments、
Elimination des produits du métabolisme.
化学不均匀性、捕获营养物质、特定分子的产生、合作/竞争、对微生物剂的耐受性、基质、结构、稳定性、水渠、细胞间内聚力、养分来源、代谢产物的消除。
生物膜基质也是细菌之间传递信号的场所,用于建立沟通网络。因此,通过所谓的“群体感应”分子(参见细菌之间的对话与合作),群体内所有成员在超过细胞浓度阈值的情况下调节各自的反应,展现出多细胞生物类型行为。这一能力使得由不同生物膜中成员产生的代谢产物得以连续使用,达到在营养水平上的代谢协作。由于生物膜内部的距离邻近性,这种群体生活形式也促进了群体成员之间DNA 片段和遗传物质的水平交换,从而有助于获得新功能。
1.3. 生物膜:休眠细菌的储存库
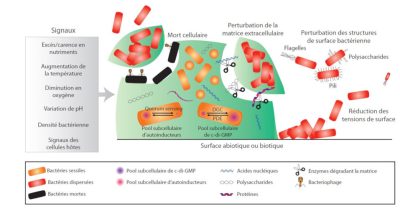
Signaux、Excès/carence ennutriments、Augmentation de la température、Diminution enoxygène、
Variation de pH、Densité bactérienne、Signaux des cellules hôtes、Mort cellulaire、
Perturbation de la matrice extracellulaire、Perturbation des structures de surface bactérienne、
Flagelles、Polysaccharides、Quorum sensing、Pool subcellulaire d’autoinducteurs、DGC、PDE、
Pool subcellulaire de c-di-GMP、Surface abiotique ou biotique、Pili、
Réduction des tensions de surface、Bactéries sessiles、Bactéries dispersées、Bactéries mortes、
Pool subcellulaire de c-di-GMP、Pool subcellulaire d’autoinducteurs、Acides nucléiques、
Protéines、Enzymes dégradant la matrice、Bacteriophage.
信号、过量/缺乏、温度升高、氧气减少、pH 值变化、细菌密度、宿主细胞信号、细胞死亡、细胞外基质紊乱、细菌表面结构扰动、鞭毛、多糖、群体感应、自诱导子细胞池、DGC 关联复合物蛋白、PDE 磷酸二酯酶、c-di-GMP 水平细胞池、非生物或生物表面、皮毛、表面张力降低、无柄细菌、分散细菌、死亡细菌、蛋白质、基质降解酶、噬菌体。
分散这一复杂现象是生物膜形成的最后一个阶段,是由营养消耗、氧浓度或细菌密度变化等外部事件诱发的(图 4)。细菌感知到这些变化,激活胞内信号,最终导致生物膜的部分脱落。因此,多种因素可导致细菌或微聚集物理分离,如基质降解酶(核酸酶、糖苷酶、蛋白酶)的合成与分泌,细菌表面修饰造成的黏附减少,产生表面活性剂引起表面张力降低或某些细菌的裂解。释放的细菌或细菌簇能够定植于其他表面,甚至由于其高毒性而产生其他感染点。
2. 以生物膜作为衡量标准重新审视感染过程

超过75%的人类感染被认为与细胞组织或医疗器械表面上以生物膜形式存在的微生物有关(图5)。这些感染包括特异性感染(如骨骼感染、耳部感染等)或与护理相关的感染,通常是由于使用侵入性设备(如导尿管、气管插管、导管等),这些设备的表面会形成生物膜(见图6)。[4] 然后细菌就会从储存库中分离出来,定植于其他表面,或进一步进入体内。这种反复的释放可导致长期感染,特别难以诊断和治疗。
主要的致病细菌来自于患者自身的微生物群(如牙菌斑微生物群,心内膜炎、肠道微生物群和泌尿系统感染)或患者周围环境中的微生物群。除了一些顽疾以外,致病生物膜通常由几种细菌种类组成(参见人类微生物:我们健康的盟友)

Lentilles de contact、Tubes endotrachéaux、Cathéters vasculaires centraux、
Prothèses valvulaires cardiaques, pacemakers et implants vasculaires、Implants mammaires、
Cathéters vasculaires périphériques、Cathéters urinaires、
Implants orthopédiques et prothèses articulaires、Infections liées à des bioflms sur des tissus、
Otites moyennes chroniques, sinusites chroniques、
(Angines chroniques, plaque dentaire,laryngites chroniques)、Endocardites、
Infections pulmonaires lors de mucoviscidose、Calculs rénaux、Angiocholites、
Infections urinaires、Ostéomyélites、Plaies chroniques.
医疗器械生物膜相关感染、心室分流、隐形眼镜、气管内管、中心血管导管、心脏瓣膜假体、起搏器和血管植入物、乳房植入物、外周血管导管、导尿管、矫形植入物和关节假体、生物膜相关组织感染、(慢性中耳炎,慢性鼻窦炎、慢性心绞痛,牙菌斑,慢性喉炎)、心内膜炎、囊性纤维化时的肺部感染、肾结石、血管胆炎、尿路感染、骨骼炎、慢性伤口。
不同微生物在同一生物膜内的共存可能会引发生态竞争,从而导致某一主体占据优势地位或在感染部位上形成特定的生态位。但事实似乎正相反。多种物种的存在似乎有助于生物膜发展过程中的协同作用。因此,最近对两种细菌(金黄色葡萄球菌和铜绿假单胞菌)的体外实验发现,金黄色葡萄球菌的主导行为有利于铜绿假单胞菌的后续定植。[5]此外,由两种生物组成的生物膜最终所包含的生物量显著大于仅包含单一细菌的生物膜的生物量总和。
同时存在不同细菌物种也可以在生物膜解体过程中发挥积极作用,从而影响细菌在生物体内的选择性传播。在小鼠模型中,病原菌对“金黄色葡萄球菌-肺炎链球菌”在鼻腔粘膜定植,肺部感染主要由肺炎链球菌引发,而金黄色葡萄球菌则被困在混合生物膜中。
这些最新数据有望改变临床诊断方法。我们不仅要考虑病原体,还要考虑在携带者或感染点位上的生态系统及微生物之间的相互作用。因此,相对于对某一特定病原体的具体研究,对微生物的整体分析在明确易感情况的预防性措施中尤为重要。
3. 或如何对抗生物膜?——抗生物膜的治疗策略
由于诸多原因,针对由生物膜引起的感染的治疗方法特别棘手。除了几种细菌共存外,生物膜的生命形式也使得治疗更加复杂,因为生物膜细菌除了其个体自身遗传的耐药机制外,还对抗感染药物表现出特定的耐药机制。[6]有一些因素导致了生物膜细菌对抗生素的“无感”,如缺乏对某些分子的渗透、由于生物膜深层氧气水平降低或局部酸性导致抗生素无效。但最复杂的机制无疑是一些细菌在生物膜中采用的类似休眠的特殊生命形式,减少了整体代谢活动,抗生素由于缺乏细胞靶点而无效(见图2)。
控制与传染病相关的生物膜意味着要么抑制其形成(即预防策略),要么分解已有的生物膜(即治疗策略),来阻止活细菌在体内的传播和定植(图7)。
3.1. 生物膜的预防策略
几种预防性策略已经被用于对抗生物膜形成的不同阶段。大量研究表明,可以通过改变材料的物理化学结构、加入抗菌剂、或在表面涂上抗粘附分子(生物表面活性剂)来防止细菌在表面的初始粘附。虽然细菌分子的性质多样,但对许多细菌分子(如胞外多糖)的研究表明,细菌在竞争环境中形成生物膜时会自然地分泌这些分子。
然而无论表面修饰的性质如何,这种方法都非常令人失望,因为这些材料很快会受到有机分子(如医疗器械中的胶原质)的影响,这些有机分子中和了抗粘附效果,甚至促进了细菌的早期定植。
为防止长期使用的导管(如透析导管)中生物膜的形成,通常可以通过在非使用时段,在管腔中加入被称为“封管溶液”的抗菌溶液(抗生素、乙醇)来实现。这种做法通过阻止细菌的生长来限制聚集物的形成。即使这种做法被证明是有效的,但高浓度抗生素的使用必然会带来生态风险,导致耐药性的产生。此外,这些溶液对材料完整性的影响仍然是未知的。
3.2. 抗生物膜的治疗策略
根除已经形成的生物膜尤其困难,不仅因为抗生素的用量需要远远超出人体常规使用的剂量,而且某些分子反而还可能对生物膜的形成产生刺激作用。理想的处理方法应该是破坏生物膜的稳定性,唤醒其休眠状态,并溶解所有微生物。已有运用酶解生物膜基质的方法(糖苷酶,核酸酶)研究,但该方法的效果只在单种生物膜中被观察到,很难由此推及到复杂的生物膜 [7]。
另一种方法是通过中和在细菌之间传递信号的分子来干扰其调节机制。尽管这些信号网络非常复杂,但许多方法已经在实验模型中被证实有效。然而,这些创新性的方法很难被实际应用,因为其主要缺陷在于这些分子在细胞外基质中被锁定和它们在生物膜中的异质分布。在任何情况下,这种方法应该与杀菌治疗相结合,以溶解从生物膜中释放出来的细菌,防止它们定植于其他部位。这只有在这些细菌细胞具有代谢活性时才能实现。因此,不仅要破坏形成的聚集物,还要唤醒休眠细胞。有几种方法可以使用,最有效的方法是通过提供营养物质促进它们的生长,或者损伤它们的细胞膜从而诱导溶解过程。一些抗菌肽能够作用于休眠的细胞膜,对靶向细菌物种具有或多或少的特异性,是抗生物膜的重要治疗方法。
总之,当进行抗感染治疗时,大多数细菌可以形成生物膜的能力是需要额外考虑的问题。目前还没有有效的策略,但如果能更好地了解这些聚集体的形成和维持机制,就应该可以在不久的将来开发出创新有效的方法。
4. 结语
我们对细菌世界的主要知识来自于在适当培养基中培养的个体化细胞形式的研究。
在自然界中,细菌主要以生物膜这一聚集群落的形式生存。这种生命形式使它们的行为协调一致,并赋予它们诸多优势,特别是它们对外部侵害的抵抗能力。
这一发现深刻改变了几十年来对细菌世界的研究,并对所有已获取的关于致病菌和共生细菌(即我们的微生物群)的数据提出了质疑。
参考资料及说明
封面照片:免版税的图片。
[1] Antoni van Leeuwenhoek (1632 – 1723) was a Dutch merchant and scientist. He is best known for his work on the microscope (thought to have been invented by Hans and Zacchary Jensen, or Galileo) of which he built many examples. He used this instrument to count the number of threads in a fabric and their thickness. His main idea was to observe the surrounding environment, and he was one of the first scientists to use the microscope to explore the world of microorganisms.
[2] J. William Costerton (1934 – 2012) is a Canadian microbiologist. A pioneer in the recognition of bacterial biofilms as the dominant mode of bacterial growth, Costerton demonstrated their importance in the resistance of bacteria to antibacterial agents and the persistence of certain chronic bacterial infections.
[3] McCoy W.F., Bryers J.D., Robbins J. & Costerton J.W. (1981) Observations of fouling biofilm formation. Can J Microbiol. 27(9):910-917; Zobell C.E. & Allen E.C. (1981) Observations of fouling biofilm formation. (1935) The significance of marine bacteria in the fouling of submerged surfaces. J Bacteriol. 29(3):239-251.
[4] Lebeaux D, Ghigo JM & Beloin C (2014) Biofilm-related infections: bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics. Microbiol Mol Biol Rev. Sep;78(3):510-543. doi: 10.1128/MMBR.00013-14
[5] Alves P.M., l-Badi E., Withycombe C., Jones P.M., Purd K.J. & Maddocks S.E. (2018) Interaction between Staphylococcus aureus and Pseudomonas aeruginosa is beneficial for colonisation and pathogenicity in a mixed biofilm. Pathogens Dis. 76, fty003; Reddinger R.M., Luke-Marshall N.R., Sauberan S.L., Hakansson P. & Campagnari A. (2018) Streptococcus pneumoniae modulates Staphylococcus aureus biofilm dispersion and the transition from colonization to invasive disease. mBio, 9 e02089-17
[6] Davies D. (2003). Understanding biofilm resistance to anti bacterial agents. Nat Rev Drug Discov 2:114-122; Lewis K. (2001) Riddle of biofilm resistance. Antimicrob Agents Chemother 45:999e1007.
[7] Ko H., Allan R.N., Howlin R.P., Stoodley P. & Hall-Stoodley L. (2017) Targeting microbial biofilms: current and prospective therapeutic strategies. Nature Microbiol Rev. 15:740-754; Miquel S., Lagrafeuille R., Souweine B. & Forestier C.(2016) Anti-biofilm activity as a health issue. Front Microbiol. 7:592.
环境百科全书由环境和能源百科全书协会出版 (www.a3e.fr),该协会与格勒诺布尔阿尔卑斯大学和格勒诺布尔INP有合同关系,并由法国科学院赞助。
引用这篇文章: AUMERAN Claire, BALESTRINO Damien, FORESTIER Christiane (2025年1月19日), 细菌生物膜与健康, 环境百科全书,咨询于 2025年1月27日 [在线ISSN 2555-0950]网址: https://www.encyclopedie-environnement.org/zh/sante-zh/health-bacterial-biofilms/.
环境百科全书中的文章是根据知识共享BY-NC-SA许可条款提供的,该许可授权复制的条件是:引用来源,不作商业使用,共享相同的初始条件,并且在每次重复使用或分发时复制知识共享BY-NC-SA许可声明。








