Aperçu sur la physique de l’effet de serre atmosphérique
PDFQu’est ce que l’effet de serre exactement ? Le rayonnement peut être décrit comme un flux de particules élémentaires, les photons, dont chacun possède un certaine énergie, proportionnelle à la fréquence du rayonnement (lire Le rayonnement thermique du corps noir). Dans l’atmosphère, lorsqu’un photon rencontre une molécule, celle-ci peut capter son énergie, mais seulement sous certaines conditions. La première est la présence d’un moment dipolaire électrique permanent. De quoi s’agit-il ? Dans toute molécule on peut distinguer l’ensemble des charges électriques positives, les protons des ses atomes, et l’ensemble des charges électriques négatives, les électrons. A chacun de ces deux ensembles on peut associer un barycentre et, si les deux barycentres ne coïncident pas, la molécule possède un moment dipolaire électrique non nul. Par contre, lorsque ces deux barycentres occupent la même position, comme dans les molécules diatomiques symétriques N2 et O2 qui sont les plus fréquentes dans l’atmosphère, le moment dipolaire électrique est nul et ces molécules ne peuvent pas participer de manière significative à des échanges d’énergie avec les photons.
Par contre, des molécules plus complexes, comme H2O, CO2 et CH4, disposent de modes vibrationnels qui leur permettent d’absorber l’énergie. Dans le cas de H2O, en position stable les deux liaisons H-O forment un angle de 120° ; elles peuvent absorber de l’énergie en battant de part et d‘autre de leur position moyenne, comme des ailes de papillons. La molécule de CO2 est linéaire et symétrique, avec deux liaisons doubles : O=C=O. Ce sont alors les positions des atomes O qui peuvent osciller de façon à absorber de l’énergie, soit en se pliant de part et d’autre de la position moyenne, soit en s’écartant et en se rapprochant de l’atome C, symétriquement ou non. D’autres espèces, présentes dans l’atmosphère, comme le méthane CH4, possèdent également des modes vibrationnels qui leur permettent d’absorber l’énergie de certains photons.
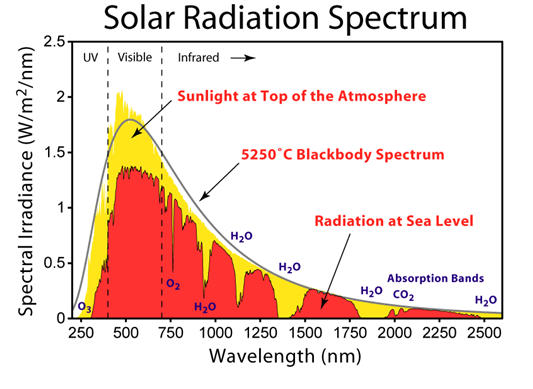
La seconde condition est liée au caractère quantique : il faut que l’énergie du photon soit égale au saut d’énergie du mode vibrationnel de la molécule. Ceci implique que les molécules ne peuvent capter que certaines longueurs d’ondes. C’est pourquoi certaines peuvent absorber le rayonnement infrarouge de la Terre dans des bandes de longueurs d’ondes bien définies, appelées fenêtres d’absorption, séparées par des bandes de transparence (Figure).
Au sein de l’atmosphère, les molécules qui ont capté une fraction du rayonnement infrarouge de la Terre l’échangent avec leurs voisines au cours de leurs collisions. Il en résulte un certain réchauffement de ce milieu gazeux, qui contribue ainsi à la distribution de température. Et l’atmosphère rayonne une part de cette énergie vers le sol et les océans (150 W/m2), ce qui constitue l’effet de serre. Les contributions respectives des diverses molécules sont très différentes. Notons, par exemple, que, par unité de masse, la contribution de la vapeur d’eau est 6 fois plus grande que celle du dioxyde de carbone, et que celle du méthane est 21 fois plus grande. Compte-tenu des teneurs respectives de ces gaz dans l’atmosphère (0,1 à 5% pour H2O, 0,035% pour CO2, environ 10-6 pour CH4) et de leurs masses molaires, il est clair que la contribution la plus importante à l’effet de serre provient de l’eau (environ 75%).
Ce focus a été écrit par René MOREAU Professeur émérite à Grenoble-INP, Laboratoire SIMaP (Science et Ingénierie des Matériaux et des Procédés), membre de l’Académie des sciences et de l’Académie des technologies et BELORIZKY Elie, Ancien Professeur à l’université Joseph Fourier, LIPhy (Laboratoire interdisciplinaire de Physique) , UGA




