Ralentir le vieillissement : la piste de la télomérase ?
PDFLe prix Nobel de médecine 2009 a été attribué aux chercheurs américains Elizabeth Blackburn, Carol Greider, et Jack Szostak [1]. Les trois chercheurs ont été distingués « pour avoir résolu un problème majeur de la biologie », à savoir : comment les chromosomes peuvent-ils être copiés de façon complète lors de la division cellulaire et comment sont-ils protégés de la dégradation. Les lauréats du Nobel ont montré en effet que la solution est à chercher aux extrémités des chromosomes : des fragments de l’ADN humain appelés « télomères » découverts par Jack Szostak [2] et dans l’enzyme qui les forme : la « télomérase » (découverte par Elizabeth Blackburn et Carol Greider) [3]. Elizabeth Blackburn a aussi démontré que la longueur des télomères et l’activité de l’enzyme télomérase, sont des facteurs importants dans d’autres pathologies (maladies inflammatoires chroniques) et le vieillissement [4].

On sait aussi maintenant que cette même télomérase s’exprime dans certaines cellules cancéreuses. Elle y jouerait un rôle dans les processus de prolifération tumorale en contribuant à l’instauration d’un état d’« immortalité » de certaines lignées de ces cellules devenues pathologiques. Elle contribuerait au moins en partie à expliquer l’immortalité de certaines lignées de cellules malignes. C’est pourquoi l’une des applications potentielles de ces connaissances fondamentales, sur les télomères et la télomérase, concerne la lutte contre certains processus cancéreux. La télomérase est donc à la frontière entre le vieillissement et le cancer, deux préoccupations majeures de notre société actuelle.
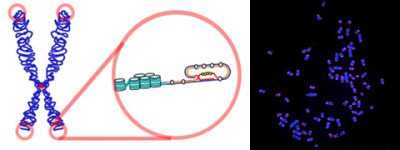
(i) sous l’influence de l’enzyme télomérase, les télomères pouvaient cesser de raccourcir et même s’allonger ;
(ii) le vieillissement était donc un processus dynamique qui pouvait s’accélérer ou ralentir voire, dans une certaine mesure s’inverser.
Avec les lauréats du Prix Nobel de Médecine 2009 et des médecins comme Dean Ornish aux USA [6], la “révolution épigénétique” – préparée par une longue série de chercheurs, de Waddington à Hayflick – a trouvé sa démonstration décisive, même si l’on doit encore parler de “théorie télomérique” de la sénescence [7].
Notes et références
[1] E Varela & MA Blasco (2010). 2009 Nobel Prize in Physiology or Medicine: telomeres and telomerase. Oncogene 29:1561–1565.
[2] Szostak JW & Blackburn EH (1982). Cloning yeast telomeres on linear plasmid vectors. Cell 29: 245–255 ; Shampay J, Szostak JW & Blackburn EH (1984). DNA sequences of telomeres maintained in yeast. Nature 310:154–157.
[3] Greider CW & Blackburn EH (1989). A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis. Nature 337: 331–337.
[4] Blasco MA (2005). Telomeres and human disease: ageing, cancer and beyond. Nat. Rev. Genet. 6:611–622.
[5] Les cytokines (du grec cyto, cellule, et kinos, mouvement) sont des substances solubles de signalisation cellulaire synthétisées par les cellules du système immunitaire ou par d’autres cellules ou tissus. Elles agissent à distance sur d’autres cellules pour en réguler l’activité et la fonction. Elles sont donc essentielles à la communication de nos cellules.
[6] Ornish D et al. (2008). Increased telomerase activity and comprehensive lifestyle changes: a pilot study. Lancet Oncol. 2008 9(11):1048-57
[7] Blackburn E & Epel E. (2017). L’effet télomère. Une approche révolutionnaire pour allonger sa vie et réduire son vieillissement. Guy Trédaniel éditeur ; ISBN : 978-2-8132-1422-5




